有源医疗器械加速老化试验效期验证及使用期限验证流程
发布日期:2023-10-10 阅读量:次
从《指导原则》分析有源医疗器械使用期限的验证
傅金德1 孔亮2 陈涛2
1 江苏省食品药品监督管理局认证审评中心 (江苏 南京 210002)
2 南京汇通检测技术有限公司 (江苏 南京 210042)
文章编号:1006-6586(2019)15-0001-04 中图分类号:R197.39 文献标识码:A
内容提要: 为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有助于提高产品的市场信任度;通过技术革新提高使用期限,有助于提高产品的市场竞争力。近日,国家药品监督管理局发布了《有源医疗器械使用期限注册技术审查指导原则》。文章将从监管角度和检测角度出发,结合《指导原则》和实际案例,分析有源医疗器械使用期限验证方法,旨在指导医疗器械注册申请人/注册人正确的开展验证工作。
关 键 词:有源医疗器械 使用期限 可靠性 技术审查 指导原则
有源医疗器械可实现对疾病的诊断、预防、监护和治疗,为了在临床使用中维持上述功能,医疗器械生产企业需确定产品的使用期限,在该期限内,要能够同时满足产品的安全使用和有效使用,即在使用期限内,有源医疗器械要同时满足安全要求和性能要求。
2014年国家食品药品监督管理总局发布第43号公告《关于发布医疗器械注册申报资料要求和批准证明文件格式的公告》,明确指出“五、(五)、1、有效期的确定:如适用,应当提供产品有效期的验证报告”。自《公告》发布以来,医疗器械注册申报资料需要包含有效期验证报告,笔者经手数百份此类报告,但是报告格式和内容千差万别,关键信息包含不全,有效期验证方案千疮百孔,经不起推敲。今年5月份,《有源医疗器械使用期限注册技术审查指导原则》正式发布,为申报人员和审评人员提供了参考格式和关键信息等内容。不仅如此,指导原则也列出了相关的参考标准,以供申报和审评人员参考使用。
1. 《指导原则》介绍
《指导原则》详细介绍了使用期限验证试验的适用范围、基本定义、适用原则、评价方式、评价路径、影响因素、评价方法 [1] 。本章将对以上内容中的重点进行介绍。
1.1 适用范围
包括有源非植入类器械和有源植入类器械,明确不含医疗器械软件。
1.2 基本定义
有源医疗器械的使用期限既要考虑器械投入使用之前的时间段(贮存运输阶段),也要考虑器械投入使用之后的时间段(工作使用阶段)。根据实际情况来分析,在贮存运输阶段,需要考虑到贮存运输对产品使用期限的影响,要开展相对应的贮存老化试验和运输包装试验;在工作使用阶段,为了更好地贴近实际使用,需要根据产品的工作特点将工作使用阶段进行划分,比如贮存阶段、待机阶段、工作阶段等,要开展相应的贮存老化试验,待机老化试验和工作老化试验等。根据以上划分,认为影响有源医疗器械使用期限
的几个阶段总结为:运输包装阶段、贮存老化阶段、待机老化阶段和工作老化阶段。
1.3 适用原则
若某有源医疗器械存在性能随时间推移而退化的情况,则该器械需提供使用期限。
当产品上市后,使用期限内未发生不可接受的风险,则可以维持或者延长预期使用期限。
当产品上市后,使用期限内产品安全和性能降低到风险不可接受的程度,应予以评估并采取措施。对于高风险产品,应通过一系列风险分析及缓解措施,保证在期限内失效率接近零。
1.4 评价方式
一种是已确定寿命,通过试验进行验证,定性分析;另一种是未知寿命,通过试验确定有效期限,定量分析。
1.5 评价路径
路径1为整机验证;路径2为部件/子系统验证。
2. 参考标准介绍
《指导原则》中将GB/T 34986-2017 《产品加速试验方法》作为参考标准之一,本章节将对该标准进行剖析,旨在为注册申请人员和审评人员梳理如何通过开展加速老化试验确定产品使用期限的路径。
GB/T 34986-2017《 产 品 加 速 试 验 方 法 》 等 同IEC62506:2013《产品加速试验方法》,由工业和信息化部提出,全国电工电子产品可靠性与维修性标准化技术委员会归口,起草单位包括工业和信息化部电子第五研究所、中国工程物理研究院电子工程研究所、总参第六十研究所、中兴通讯公司、海信集团有限公司等十二家研究机构,具有绝对的专业性 [2] 。该标准于2017年11月1日发布,于2018年5月1日实施。
2.1 加速试验方法概述
任何类型的加速试验都是基于加速损伤理论。产品在生命周期内所承载的各种应力,会对产品造成渐进式的损伤累积,当损伤累积到一定量值,就会导致产品失效(如图1)。
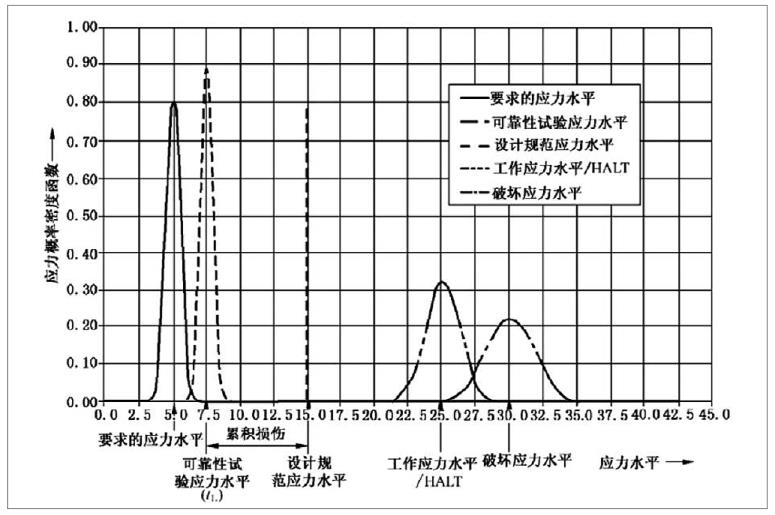
图1. 累积损伤、退化的概率密度函数及试验类型[2]
这里的“量值”可能会在产品生命周期内达到,也可能不会。
图1中的曲线表示了在产品使用期限内(从使用开始时刻t0到寿命终结tL)对应于某一应力的要求强度。试验中的产品强度和应力假设服从高斯分布。图1可作为一个概念模型,展现了不同的加速试验类型。
基于加速损伤理论,任何类型的加速试验都是通过增加试验应力的方式,使其对产品造成损伤,在试验周期内的损伤累积与产品使用期限内应力造成的损伤累积等效[2]。
结合试验中获取的相关信息以及产品的使用状态假设,加速试验方法分为三种类型:
2.2.1 定性加速试验
《产品加速试验方法》称之为A类验证,用于发现故障模式和(或)故障现象。
通过对产品施加比其工作应力极限高得多的应力水平来找到这些缺陷,在试验过程中激发产品全部的功能性能问题。进而确定产品的失效模式,产品设计的薄弱环节及工作应力极限与设计应力极限之间的裕度。
2.1.2 定量加速试验
《产品加速试验方法》称之为B类验证,用于预计产品正常使用时的失效分布,可以结合C类验证预计产品使用期限。
该类试验的应力水平比产品使用时要求的应力水平高,但是低于加速极限试验所施加的应力水平。基于具体失效机制确定定量加速因子,该加速因子确定了产品在特定试验应力与其使用环境应力下所能经受的时间之间的关系。通过提高比特定使用应力高的试验应力来缩短试验时间,试验应力水平产生了与产品使用期限内等同的累积损伤效应,可以很显著地缩短试验周期。随着试验的进行,当产品性能参数(和安全参数)达到不可接受的程度,即认为产品发生失效。
2.1.3 定量时间/事件压缩试验
《产品加速试验方法》称之为C类验证,用于预计产品正常使用时的失效分布,可以结合B类验证,预计产品使用期限。
主要用于评估以耗损型为主要故障模式的部组件的寿命时间,应力水平的增加是通过延长应力施加的持续时间或频次而不是增加其应力量值来实现的。
2.2 加速实验模型
2.2.1 A类试验。A类试验包括高加速极限试验(HALT),高加速应力试验(HAST),高加速应力筛选/抽查(HASS/HASA)。可用于研发阶段对产品可靠性的评估和提高,这里不做深入介绍。
2.2.2 B类试验。B类试验是定量加速试验的一种,是为了评估一项或多项可靠性量值。用于确定具有有限使用期限的组件的使用期限或是为了量化产品的可靠性。开展加速试验,需要充分了解产品潜在的失效机制以及工作和环境应力,可以通过对产品在预期的使用剖面下的失效模式分析来实现。该类试验既要防止产品在预期寿命或应力下过早的失效,也要使失效机制在加速试验过程中得到有效激发。
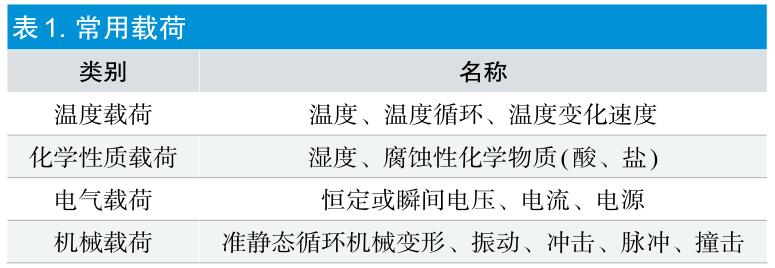
加速因子(AF或A)指产品预期使用条件下的寿命与加速试验条件下的寿命之比,是加速老化试验的加速程度的体现。加速因子取决于产品的材料特性、产品组成、预期使用应力、加速试验应力以及相关失效机制。常用于施加应力的载荷,见表1。
2.2.3 C类试验。C类试验分为时间(C1)压缩和事件(C2)压缩。
C1类试验:C1类试验是通过增加“工作时间”和减少“非工作时间”来压缩工作循环的方式实现时间压缩。这类试验主要考虑“工作时间”内预期应力(主应力)对产品的影响,对于“非工作时间”某些应力对产品造成的损坏忽略不计。
虽然“非工作时间”中导致失效模式的应力相比“工作时间”中所受应力小的多,但施加的时间相当长,使其产生的累积损伤与产品使用应力所引起的相当或者更大。鉴于此,作者认为在使用C1类试验时,有必要将“工作时间”和“非工作时间”的加速试验结合起来考虑。在开始时间压缩试验之前,可施加“非工作时间”的应力对产品进行预处理。
C2类试验:事件压缩试验是指以高于产品实际使用时的频次对事件进行重复应用。比如开/关循环。
2.3 应力模型
产品的使用期限可能受到单应力或多应力的影响。当使用期限受到两种或更多应力影响时,可利用与这些应力相匹配的模型,通过增加各单一的应力来完成试验加速,总体的可靠性或失效概率必须予以分别评估。常见的单应力模型见表2。

3. 使用期限验证流程
《指导原则》明确指出,可以通过开展加速寿命试验来验证有效期限。加速寿命试验是在进行合理工程、统计假设及不改变产品故障模式和故障机制的基础上,利用与物理失效规律相关的统计模型对在超出正常应力水平的加速环境下获得的可靠性信息进行转换,得到试件在额定应力水平下可靠性特征的可复现的数值估计的一种试验方法[1]。《指导原则》特别强调了每个加速模型都有其适用范围,在选择相应的加速模型时要考虑其适用于试验应力的类型和试验对象[1]。开展加速寿命试验需确定以下相关参数:试验持续时间、样本数量、试验目的、要求的置信度、需求的精度、加速因子、实际使用环境、试验环境、加速因子计算、威布尔分布等[1]。
根据《指导原则》的要求,正确开展加速寿命试验,需要包含以下步骤:
①根据产品特点确定评价路径。
②确定样品数量。
③给定预期使用期限和置信度。
④确定临床适用应力剖面。
⑤确定应力大小。
⑥选择失效模型。
⑦根据文献资料确定模型中系数数值。
⑧计算加速因子。
⑨确定加速试验时间。
⑩确定功能测试项目。
⑪确定失效定义。
⑫数据处理,失效分析。
笔者以上海某医疗器械公司某监测仪为例,按照上述步骤,介绍加速寿命试验的开展过程。
①根据产品特点确定评价路径:功能单一,选择整机验证。
②确定样品数量:整机10台。
③给定预期使用期限和置信度:预期使用期限10年,置信度99%。
③确定临床使用模式:某监测仪使用阶段有三种模式,分别为贮存模式、待机模式和工作模式。
④确定临床使用应力剖面:考虑到某监测仪用于手术前对患者的监测,临床使用应力主要为温度和湿度。参考温湿度:25˚C,60%RH。
⑤确定应力大小:贮存模式最高耐受温湿度:60˚C,93%RH;待机模式最高耐受温湿度:55˚C,85%RH;工作模式最高耐受温湿度:45˚C,85%RH。
⑥选择失效模型:根据临床使用应力剖面,参考D.S.Peck提出的温度和湿度应力的加速模型:Peck模型。
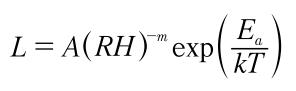
⑦根据文献资料确定模型中系数数值:查阅Telcordia sr332 2016版电子产品可靠性预计标准,确定系数Ea取1.0eV,n取2.66。
⑧计算加速因子:根据不同临床应用不同模式,计算在各模式下的加速因子:

⑨确定加速试验时间:设备标称使用期限10年,最多含3个闰年,每周使用7d,每天使用5h,待机3h,其余时间计入贮存时间。则产品贮存总时间为58448h,待机总时间为10959h,工作总时间为18265h。根据GB/T34986-2017《产品加速试验方法》的要求,设置裕度10%。
贮存模式加速老化时间 =(贮存总时间×(1+10%))/TAF1=336.77h
待机模式加速老化时间 =(待机总时间×(1+10%))/TAF2=136.32h
工作模式加速老化时间 =(工作总时间×(1+10%))/TAF3=689.96h
总测试时间为1163.05h,换算为48.5d。
⑩确定功能测试项目:根据产品技术要求,确定某测试范围和测试精度为基本性能测试项目,根据GB 9706.1-2007,确定接地电阻、漏电流和电介质强度为基本安全测试项目。
⑪确定失效定义:当基本性能测试项目或基本安全测试项目中任意一项测试未通过时,判定整机失效。
⑫数据处理,失效分析:试验结束,共失效1台设备,进行概率统计分析,得出结果为“平均使用期限的下限为14.1年,置信度99%”。
4. 小结
《有源医疗器械使用期限注册技术审查指导原则》的正式发布,为使用期限验证提供了规范的测试方法,便于注册申请人/注册人开展验证试验,也便于审评人员审核验证报告。
GB/T 34986-2017《产品加速试验方法》为开展医疗器械加速寿命试验,给出了多种模型可供选择,为使用期限验证提供了可以量化的参数。
结合《指导原则》和《产品加速试验方法》,能够使验证方案更加合理,验证过程更加严谨,条理清晰、关键信息更加完备。
加速寿命试验实际上是可靠性试验的一部分,可靠性试验在家电领域和汽车领域已经开展的很成熟了。而作为要求本该更严格的医疗器械领域,可靠性试验却刚刚起步。提高医疗器械的可靠性,任重而道远。希望《指导原则》能够开辟出一条适用于医疗器械的可靠性试验之路。
参考文献
[1] 国家药品监督管理局.关于发布有源医疗器械使用期限注册技术审查指导原则的通告(2019年第23号).[2019-05-14]. https://www.cmde.org.cn/CL0056/19155.html.
[2] 国家质量监督检验检疫总局.GB/T 34986-2017 产品加速试验方法[S].2017.
原文下载:《从指导原则分析有源医疗器械使用期限的验证》傅金德

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
行业资讯
知识分享








 豫公网安备 41010202003160号
豫公网安备 41010202003160号