CRF数据获取协调标准(CDASH)和CRF表设计流程
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
ICH-GCP将病例报告表(CRF)定义为一种印刷的、可视的或者是电子版的文件,用于记录每个受试者的所有试验方案要求的信息,向申办者报告。CRF作为医疗器械临床试验采集重要的必备工具,下面将介绍一下目前使用最为广泛且被监管部门所推荐用于CRF设计阶段的数据获取协调标准(CDASH)(临床数据交换标准协会(CDISC)标准之一),以及CRF设计的流程。

数据获取协调标准(CDASH)
CRF必须包含试验方案所要求的所有字段,是CRF设计的基本要求,然而对于方案要求采集的字段是否合理,如何怎样才能更大程度上保证正确的采集所需数据,也极其重要。而数据获取协调标准(CDASH)则提供了极佳的参考。
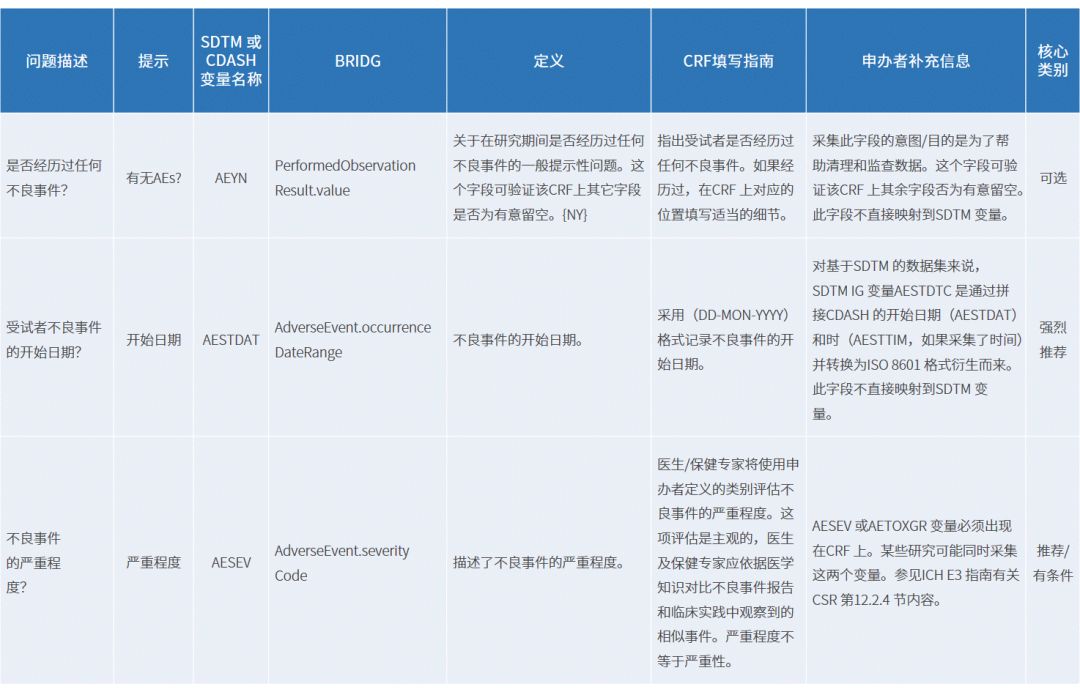
CDASH定义了临床试验数据采集的基本标准。CDASH中按照数据类型划分数据域,如既往病史(MH)、实验室检查结果(LB)、不良事件(AE)等,并为数据域中的每个字段从问题描述、提示、SDTM 或CDASH 变量名称、BRIDG、定义、CRF填写指南、申办者补充信息、核心类别8个方面进行提供了统一的标准(详见表1)。其中,核心类别分为强烈推荐、推荐/有条件、可选,“强烈推荐”字段一般是根据监管部门的要求,因而一般为必选采集字段,对于推荐/有条件、可选可根据试验情况、法规等方面进行适当选择。如不良事件(AE)域列表中总共列举了23个字段,强烈推荐、推荐/有条件、可选的个数分别为6、11、6。

CDASH极利于数据从采集到递交过程转换。美国、日本等国家的监管部门均建议在新药注册时按照数据递交标准(SDTM)递交数据,我国自2017年加入ICH后,也在慢慢的靠拢。作为CDISC系列标准中的一环,89%的CDASH变量与数据递交标准(SDTM)完全相同,为数据的转换提供了极大的基础便利。
但由于每个临床试验都具有特异性,因而CDASH只能最大程度上提供常用数据域及字段标准作为参考,无法囊括所有的数据列表以及试验情况。但由于CDASH对数据域及字段的命名和定义都是采用统一的规则,所以当试验中出现新的数据域及字段时,仍可参照其标准进行命名和定义。
CRF设计的一般流程
如果试验计主要评价指标相关的数据点没被采集,那么试验即可等同于失败,因而CRF设计极其重要。
CRF设计应有严格的sop对开发、审核、批准、版本控制及研究中心培训的流程进行控制。CRF设计员应把包括初稿、审核意见版、定稿及定稿后更新的所有版本进行归档,定稿的版本最终由审核各方进行签字批准。CRF审核应由参与方案设计的相关人员进行审核,例如统计、医学、运营、研究者,从各自专业的角度进行审核,并统一反馈至CRF设计员。需注意的是,CRF次定稿之后若发生CRF更新,应重新进行审核、批准。
再完美的标准和完美的sop,都不如完美的实施。CRF的重要无需重复,CRF设计的成功源于对每个数据点的执着与用心。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
行业资讯
知识分享









 豫公网安备 41010202003160号
豫公网安备 41010202003160号