药物临床试验流程图(药物临床试验全流程梳理)
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
临床研究在整个药物研发过程起着决定性的作用,而临床试验作为重要的表现形式,一方面可以对新药审评和注册提供法规要求的申报资料,为企业研发新药、明确市场战略决策提供依据,另一方面可以评价新药潜在的临床应用价值、确定新药的最佳使用方法,为广大患者带来福音。因此,本文针对临床试验全流程进行整合阐述。
临床试验全流程
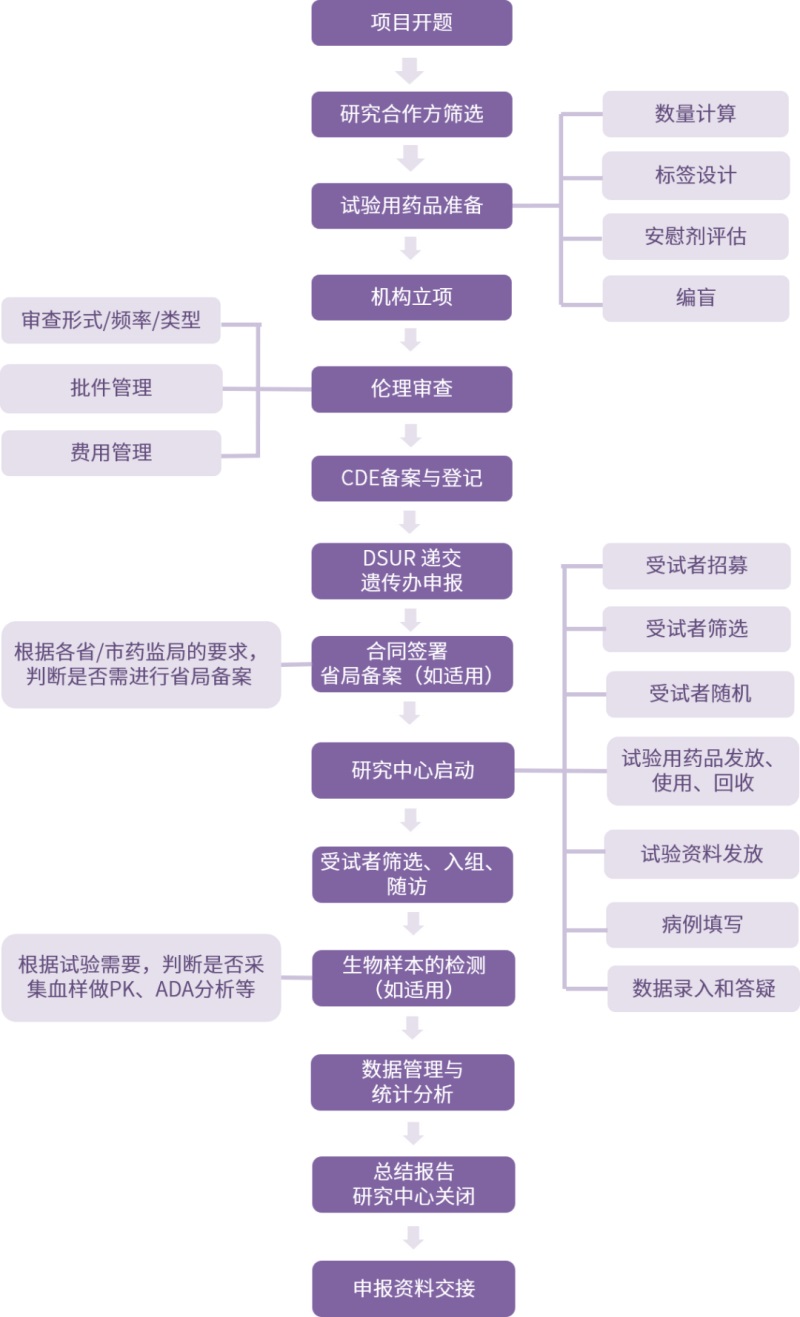
临床试验复杂而漫长,涉及环节众多,细节繁琐,在试验过程中对各环节内容、各中心制度流程及相应的法律法规的熟悉程度,决定了临床试验进程的快慢,以下总结了有关研究合作方筛选、机构立项、伦理审查、研究中心关闭等环节的具体内容及相关要求。
01研究合作方筛选
研究合作方筛选主要包括研究中心筛选和供应商筛选:
(1)研究中心筛选
由于临床研究涉及人体的临床医学研究,对于研究中心的选择显得尤为重要,选择的条件主要包括:研究中心是否具有入组受试者的能力及能承担的病人数量、医疗设施是否符合要求、是否具有足够的设备和相关的研究人员、是否具有临床研究经验;研究者是否具备专业领域及行政管理的资质等。
(2)供应商筛选
供应商筛选主要针对数据管理单位、统计分析单位、生物样本检测单位、SMO、招募、物流等进行选择。
02机构立项
在机构申请立项时,需通过各种渠道主动获取立项流程和相关要求,有针对性的进行相关文件的准备,明确相关的要求,包括资料份数、盖章、装订要求、各阶段时限等,以便于能够高效的与研究者进行沟通,顺利推进临床试验进程。
03伦理审查
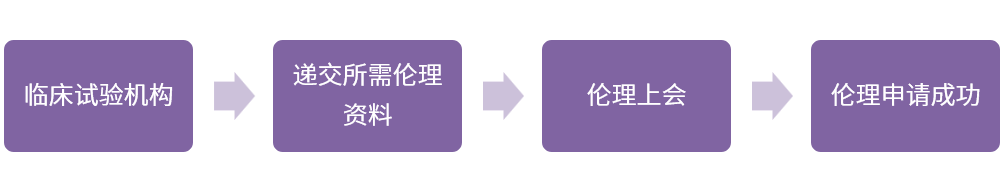
(1)咨询伦理相关内容
◆ 递交资料的清单、数量及特殊要求,例如装订形式、打印要求、是否盖章等;
◆ 接收资料的最后期限、伦理上会是否需要提供PPT、PPT讲解人、伦理会监查员是否可以参加;
◆ 伦理会召开的频率及最近一次召开的日期、获得伦理批件的时间;
◆ 伦理审评费、付款方式、医院帐户、获取发票的流程等。
(2)伦理资料递交的准备
◆ 准备伦理递交信,递交文件列表处要正确列出版本号、版本日期;
◆ 为PI准备伦理上会PPT;
◆ 所有递交给伦理委员会审批的文件必须是最终版的,应有主要研究者签字;
◆ 伦理委员会审批后的文件,如有任何更改,都必须通知伦理委员会备案。
(3)合同
◆ 在筛选中心时和各机构确定合同模板、签订流程及合同签订顺序;
◆ 了解机构收取管理费用比例;
◆ 筛选中心开始到各分中心伦理通过或伦理备案完成后;
◆ 合同审核工作,最好与伦理递交、审核同时进行;
◆ 分中心伦理通过后签合同;
◆ 签定合同后付第一笔款。
04CDE登记
CDE登记时间:
◆ 首例受试者签署知情同意书前;
◆ 信息更新后20个工作日内(如首例受试者签署知情同意书,方案、伦理等信息变更等);
◆ 因安全性原因主动暂停或者终止临床试验后10个工作日内;
◆ 项目完成后12个月内。
05研究中心启动
研究中心启动主要分为启动前准备、启动实施、启动跟进三部分。
(1)启动前准备
该阶段需进行研究机构硬件设备确认,试验用药品、物资确认,建立研究文档,发送启动访视确认信、申请启动费用及准备培训资料等。
(2)启动实施
该阶段需针对临床试验方案、试验用药品的管理(存储、发放、配置、使用、回收、销毁、异常(如超温)情况处理等)、合并用药的管理(允许使用和禁止使用的药品)、CRF填写或eCRF录入指南等与相关人员进行培训,同时进行研究人员资质、培训资料等收集。
(3)启动跟进
跟踪启动会过程中的未解决问题,撰写并发送启动访视报告及随访信。
06数据管理与统计分析
(1)数据管理
首先需撰写数据管理计划(第一稿在首例受试者签署知情同事书前定稿),由临床数据管理员进行数据的审核及清理,后召开数据审核会(如是盲法试验,还需进行盲态审核),形成数据审核报告,锁定数据库,最后撰写数据管理报告。
(2)统计分析
在数据库锁定之前,撰写统计分析计划并定稿,在数据库锁定后,进行第一次揭盲,撰写统计分析报告。
07研究中心关闭
确定试验资料将存放的条件和归档程序、研究者文件夹中的资料完整性,清点中心的入组受试者数量、清点试验药品、相关文件,将临床研究文件归档,并组织安排将药物返还给申办者等。
来源:新领先药讯

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
行业资讯
知识分享









 豫公网安备 41010202003160号
豫公网安备 41010202003160号