临床试验不良事件的相关性判定
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
不良事件相关性判定,基于什么原则来考虑?参考研究者手册?去激发、再激发?
七分、六分、五分、二分...为什么相关性判定的分级方式不同, 哪一种才是权威的?
众多相关性判定方法如何来分类,哪一种适合用到方案中?I期试验也适用吗?
本篇文章中,你可以:
1.了解不良事件相关性判定的宗旨、原则和分类
2.了解国际和国内权威和常用的相关性判定方法
3. 了解基于原理的判定方法分类及I期试验的考量

01 相关性判定概述
临床试验过程中,规定报告时限内的不良事件(AE, Adverse Event),只要符合不利的医学事件,包括症状体征、疾病或实验室检查异常等,无论是否与试验药品存在合理的可能性(即药物不良反应ADR,Adverse Drug Reaction),均需要报告。
研究者需在报告AE时提供和试验药物的相关性判断,这将是评价与药物相关的不良事件发生率, 导致停药/死亡的AE发生率等试验关键信息的依据,也是评价一个治疗方案获益/风险的重要考量。
尽可能真实、合理的相关性判断,就成为保证试验质量的重要一环。
不良事件相关性判定过程中,经常存在缺少足够明确依据、值得讨论的情况。那应该从什么宗旨和原则出发,基于什么判定方法考虑呢?
(1)相关性判定的宗旨:基于方案
临床试验中安全信息的收集与评价遵循法规,基于方案,参照研究机构的SOP要求执行。
研究者审阅方案时,可以与申办方就不良事件相关性的判定方法进行沟通。方案审阅完成并经伦理委员会通过,则评价过程需要严格按照方案的定义进行不良事件的相关性判定。
(2)相关性判定的原则:Hill准则
判断不良事件与试验用药的相关性,目前应用较为广泛的原则是Hill准则。
英国 Austin Bradford Hill 爵士于 1965 年在一个关于环境和疾病的开创性报告中描述的用于因果关系评价的准则,包含9项细则:关联的时序性、一致性、强度、特异性、生物梯度、实验支持、合理性、连贯性、类比。
其中最重要的就包括:
1.时序性(temporality):合理的时间关系是判断相关性的首要条件。相关的AE应发生于用药后合理的的时间间隔,符合药物动力学和疾病病理学知识,否则不能假设因果关系。
2.一致性(consistency):与药物已有的信息一致。不同地区、不同人群、不同时间暴露在同一因素下可观察到同样的事件发生,如参考研究者手册。
3.特异性(specificity):考虑混杂因素导致的可能性。基础和伴随疾病的异常,合并药物的相互作用,以及其他诊疗过程的影响。
4.强度(strength)与生物梯度(biological gradient):疾病与暴露因素之间关联程度的大小,以及剂量反应关系。通过去激发(dechallenge)与再激发(rechallenge)试验,观察停药与减量后临床事件是否继续存在、减轻或消失,再次用药后临床事件是否复现,以此支持试验药物和不良事件的相关性。
除此之外,从发病机制上建立因果关系的合理性(plausibility),与现有理论和知识的连贯性(coherence),以及实验支持(experimental support)和类似药物的类比(analogy),都可作为判定相关性的依据。
Hill准则中,除了时序性必须满足以外,其他细则满足的越多,因果关系成立的可能性越大。
(3)相关性判定方法的分类
相关性判定原则的基础之上,目前已经建立了几十种不同的相关性评价方法。
根据相关性判断的分级方式,可大致分为:
1.七分法:肯定、很可能、可能、可疑、不相关、待评价、无法评价 / 判断;
2.六分法:肯定、很可能、可能、可疑、待评价、无法评价 / 判断;
3.五分法:肯定相关、很可能相关、可能相关、可疑/可能无关、不相关/不可能;
4.二分法:相关、不相关。
根据相关性评价应用的不同基本原理,判定方法可以分为三类:专家判断法,标准化算法以及概率化法三类。有兴趣了解的话,将在第三部分扩展介绍。
02 判定方法介绍
不同的判定方法,在应用的原则以及分级方式上有所不同。目前应用较多的判定方法为六分法和五分法。下面分别介绍国际和国内最权威和广泛使用的评价方法。
(1)六分法:WHO-UMC 及中国ADR工作手册
WHO-UMC评定法
WHO国际药物合作中心,又称乌普萨拉监测中心(UMC,Uppsala Monitoring Center),是全球性的药物安全性组织。其推荐的WHO-UMC评定法是目前全球最普遍应用的相关性判定方法。
UMC法将相关性分成6级,包括肯定(certain)、很可能 (probable/likely)、可能 (possible)、不可能(unlikely)、待评价(conditional/unclassified)、无法评估/分类(unassessible/unclassifiable)。
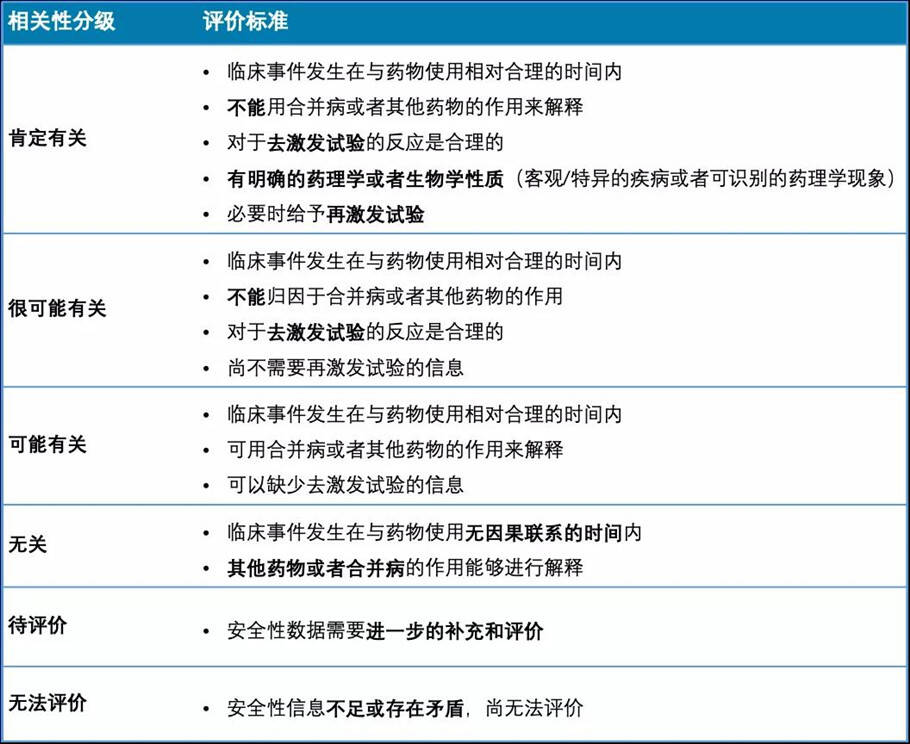
WHO-UMC评定法的分级及评价标准
药品不良反应报告和监测工作手册
参照WHO-UMC评定法,中国监管机构权威的判定方法来自《药品不良反应报告和监测工作手册》,于2005年颁布,2012年进行了修订。
工作手册的关联性评价与WHO-UMC一样分为肯定、很可能、 可能、可能无关、待评价、无法评价6级。
其相关性判定方法遵循5条原则:
1. 用药与不良反应事件的出现有无合理的时间关系?
2. 反应是否符合该药已知的不良反应类型?
3. 停药或减量后,反应是否消失或减轻?
4. 再次使用可疑药品是否再次出现同样反应事件?
5. 反应事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?
其中1体现了Hill准则的时序性,必须要满足;2通过已知反应体现一致性;3、4通过去激发和再激发体现了生物梯度,5则通过排除其他原因体现了特异性。
根据5条原则,其相关性分级判定如下表:
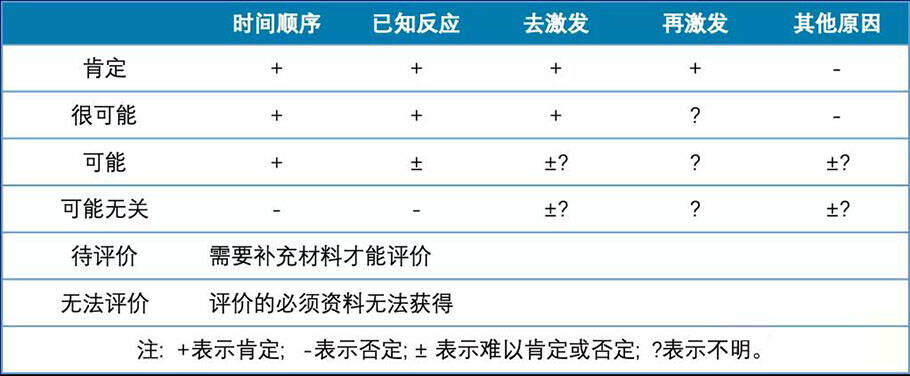
工作手册的相关性分级判定
六分法中存在待评价意为需要补充资料。当客观原因无法获得进一步信息,缺项太多、资料无法补充,才选择无法评价。
(2)五分法:Karch和Lasagna 及 原卫生部评定法
在新药注册试验中常要求对AE有一个明确的相关/无关判定以进行统计分析。
因此目前在临床试验中很多使用的是五分法。下面介绍国际和国内使用较多的五分法。
Karch 和 Lasagna 评定法
Karch和Lasagna评定法是经典的五分法,对后来相关性判定方法的发展有重要的影响。澳大利亚、瑞典、新西兰等国的评定方法也在此基础上发展而来。
其中相关性分为肯定、很可能、可能、条件、可疑5级。
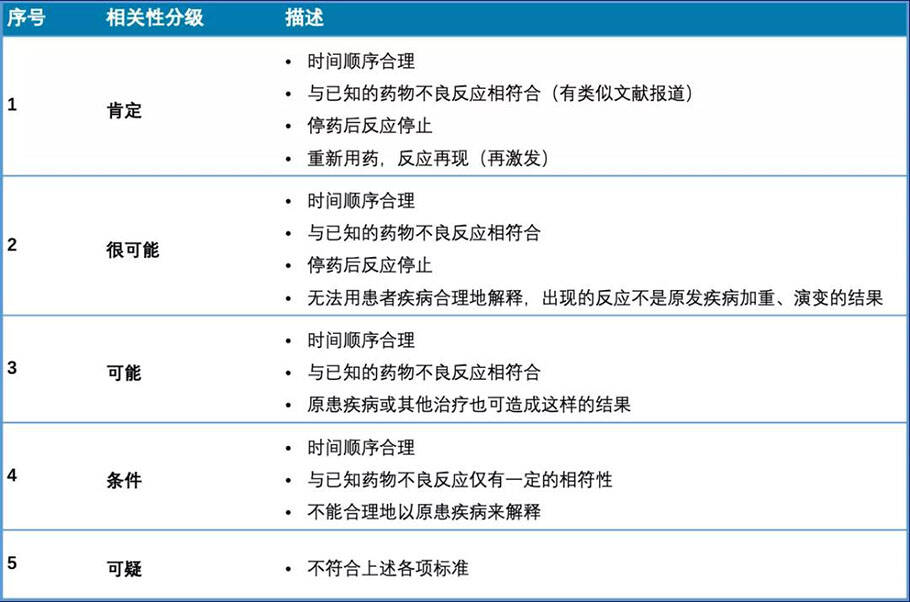
原卫生部评定法
在Karch 和 Lasagna 评定法的基础之上,1994年原卫生部国家药品不良反应监测中心制定了五分类的评定方法,在此称为原卫生部评定法,考虑了不良反应发生的时序性、一致性、发生强度、特异性方面的因素。
五分法分级为肯定有关、很可能有关、可能有关、可能无关、肯定无关。
其中肯定有关、很可能有关、可能有关作为相关的不良事件。
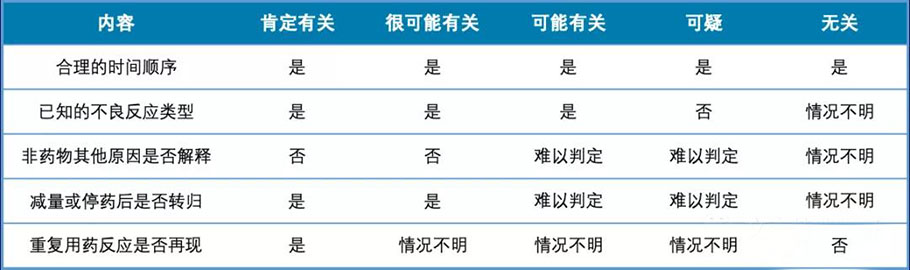
原卫生部评定法的相关性分级
03 扩展介绍
以上介绍的判定方法并不能解决所有的相关性问题。
依据标准化算法和依据概率论语言进行相关性判定的方法,克服了依靠主观经验的局限性。
I期试验中面临的特殊问题,也使得标准的六分法、五分法判定的应用存在局限。
(1)不同原理的判定方法分类
根据不同的评价方法的基本原理,主要可分为三类:
1.专家判断(expert judgment)又称全面评估法(global introspection):基于目前该领域专家的知识和经验进行评估而得出关于因果关系的结论。
2.标准化算法(algorithms):通过半定量的方法对特定问题赋值,根据总分划分因果等级。
3. 概率化法(probabilistic approaches):运用概率论语言进行可疑AE因果关系评价。

基于原理的相关性判定分类及介绍
(2)I期试验相关性判定
I期试验尤其是FIH试验, 常仅能参考临床前毒理研究。由于种属差异,而导致相关性评价的一致性依据有限。
单次给药的试验,不能通过减量、停药以及再次使用的方法来观察。很难通过强度和剂量反应关系来进行判断。
对于I期试验,目前缺少较为权威的AE相关性评定方法。
一致性和剂量反应关系依据缺乏的情况下,更依据Hill准则的其他细则,包括从机制、理论的合理性和连贯性,以及通过类比其他相似药物来进行判断,必要时可以召开专家讨论会,对疑难病例再次评价。
04 总结
本次介绍了临床试验相关性评价的宗旨、原则以及判定方法及应用。
1、临床试验的相关性判定宗旨是依据审阅一致的试验方案,判定基于Hill原则的9条细则,尤其是时序性、一致性、特异性和强度及生物梯度。
2、分别从国际和国内角度,介绍了目前权威的六分法:WHO-UMC 及中国ADR工作手册方法,以及五分法:Karch和Lasagna评定法及原卫生部评定法。
3、扩展介绍了依据基本原理分类的三类方法:专家判断法、标准化算法以及概率化法,以及I期试验不良事件相关性判定的特别考量。
希望能有一点点帮助。
参考文献:
1. The Uppsala Monitoring Centre (the UMC). Safety monitoring of medicinal products:guidelines for setting up and running a pharmacovigilance center
2. Causality Assessment in Premarketing Drug Clinical Trials: Regulatory Evolution in the USA and Ongoing Concerns. Drug Safety 39, 10 2016.10: 895–901.
3. 曹烨,万邦喜,苏敏实.药物临床试验 安全评价·广东共识(2020年版)[J].今日药学,2020,30(11):731-740.
4. 王春华,胡晓,杨翠翠等.Ⅰ期临床试验中不良事件的因果关系评价[J].药物不良反应杂志,2019(01):30-35.
5. 魏戌,谢雁鸣.国内外不良反应因果判断原则及评价方法解读[J].中国中药杂志,2012,37(18):2744-2747.
6. 李博,高蕊,李睿等.药物临床试验不良反应/不良事件关联性判定方法研究探讨[J].中国新药杂志,2014,23(12):1465-1470.
作者:文森特

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
行业资讯
知识分享









 豫公网安备 41010202003160号
豫公网安备 41010202003160号