英国UKCA医疗器械产品市场准入要求说明
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次

英国已经正式脱欧,那么从2021年1月1日起,医疗器械进入英国境内,就需要申请“UKCA”。
UKCA认证产生的背景
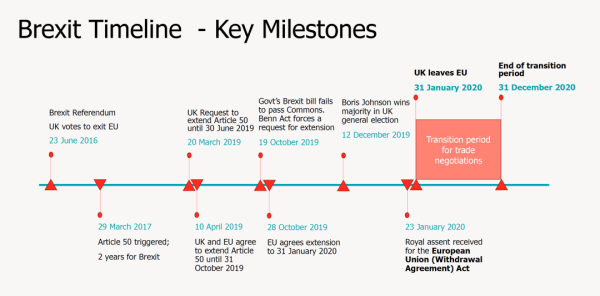
UKCA产生的大背景是英国脱欧。英国脱欧后,不再沿用之前欧盟框架下的市场准入的法规和制度,而建立英国自身的市场准入法规和制度。因此产生了UKCA认证标志。从下图可以看出,英国脱欧的过渡期将在2020年12月31日结束。从2021年1月1日后,UKCA标志就启用了。UKCA标志覆盖很多领域,基本上包含了原CE新方法指令的所有范畴。本系列文章主要讨论的是医疗器械领域,包括通用医疗器械、体外诊断医疗器械以及有源植入性医疗器械。
UKCA是什么,即英国合格评定,是英国产品符合性标识,不过此标识只适用于英格兰、苏格兰和威尔士,不适用于北爱尔兰。
突然要用UKCA标识,很多企业来不及办理呀,别急,这里给的有过渡期,从2021年起,到2023年6月30日,进入英国的产品可以继续使用CE标识,不必须用UKCA标识,但是从2023年7月1日起,就必须使用UKCA标识。
UKCA过渡期到底是2021年1月1日,还是2023年7月1日?两个过渡期都对,但理解不同。在2021年1月1日前没有取得CE的产品,该日后需强制认证UKCA,单独认证CE就无法进入英国市场。已经取得CE认证的医疗器械产品,可以沿用到2023年,到2023年7月后,强制认证UKCA。
医疗器械UKCA合规时间法规依据
医疗器械的加贴UKCA标志的要求,总体上可以分为UKCA合格评定和MHRA注册申报两大模块。英国MHRA在今年9月初和12月初分别发布了针对2021年医疗器械制造商如何将产品合法的投放英国市场的指南文件。这两份文件对于制造商的合规日期有明确的表述。
UKCA合格评定
1)对于目前持有公告机构签发CE证书的制造商,在 2023年6月30日,可以继续使用CE证书将产品出口到英国(UK)市场。在2023年6月30日之后,还可以继续出口到英国的北爱尔兰(NI)市场,而不再能出口到GB(英格兰、苏格兰和威尔士)市场。所以,从2023年7月1日开始,原来需要通过公告机构CE证书出口的医疗器械,要继续出口到GB市场,需要取得获认可的英国认证机构签发的UKCA的证书。
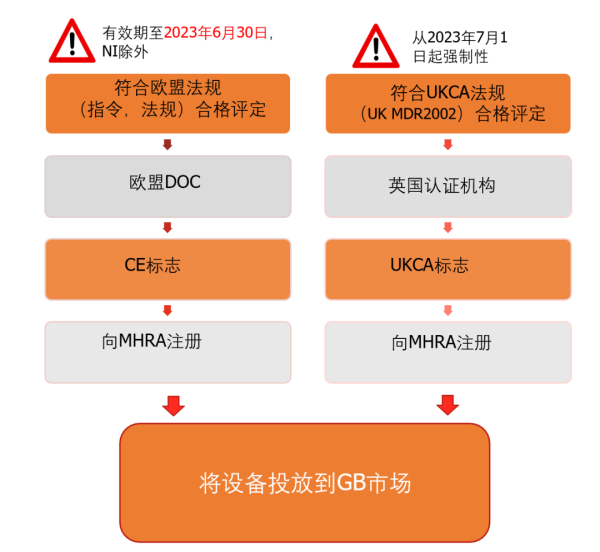
2)对于自我宣告类产品(依据MDD指令和IVDD指令),在2021年1月1日开始就可以按照UK MDR 2002的要求来准备技术文件和相关支持性材料,以完成自我宣告,加贴CE标记。
要想把产品投放到英国市场,应该怎么做呢?
1、申请UKCA标识
不同的产品有不同的方式,比如:
普通一类MD和普通IVD的,不需要公告机构介入,只需要做自我申明,但是制造商必须做产品测试和提供技术文档;
I类灭菌和I类测试的,做自我申明的同时,还需要公告机构介入,而且制造商必须做产品测试和提供技术文档;
2、进行MHRA注册
进行MHRA注册,通过注册在英国境内的代理人来做注册。MHRA更新了器械注册的规定,在脱欧之前,需要在MHRA注册的器械只包括一类器械,通用类的IVDD以及定制器械。但是脱欧后,MHRA要求所有类别的医疗器械都需要在MHRA进行注册。不过MHRA英国政府依据不同的产品给出了为期一年的过渡宽限期,基于产品风险等级高低,分别是4个月,8个月和12个月。详细信息如下:
(1)IIb类可植入医疗器械、III类医疗设备、有源植入类医疗器械及IVD列表A的宽限期到2021年4月30日(4个月);
(2)IIb类非植入式医疗设备、IIa类医疗器械、IVD列表B、自测IVD的宽限期到2021年8月31日(8个月);
(3)I类医疗器械、普通IVD的宽限期到2021年12月31日(12个月)。
可以看出,对于一类医疗器械和通用类的体外诊断的时间是2021年12月31日。那么对于之前在MHRA注册过的器械,我们该如何处理呢?MHRA的指南文件给出了如下信息:
(1)对于原本就有注册义务的,不适用该过渡期;MHRA在12月7日更新的文件进一步表述了这个指的是英国境内的制造商,以及签约欧盟授权代表是位于爱尔兰的境外制造商。
(2)原来通过欧盟授权代表在英国MHRA进行的注册,在2021年1月1日起全部失效。需要重新指定英国代表,重新申报注册。
(3)英国境外的制造商应尽早指定英国代表。
UKCA证书


站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
行业资讯
知识分享









 豫公网安备 41010202003160号
豫公网安备 41010202003160号