临床试验方案设计的基本规范
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
临床试验设计(clinical trial design)或称临床研究方案是临床研究设计、实行、报告和评价的基础。一篇高水平的临床科研论文不仅在理论上有所领先,方法先进,而且具有完整、严谨的试验设计及科学的统计学方法。循证医学的快速发展证明了以规范严谨的科研设计为基础并正确运用统计学的论文才是高质量的论文。然而,从一些调查研究可以看出,国内的科研论文尤其是临床试验论文的质量并不高,有些所谓的随机临床试验(randomized clinical trials,RCTs)并不是真正的RCTs。国内外的研究均表明,科研设计不完善是造成论文质量不高的重要原因之一。本刊来稿中有2/3的稿件是临床科研型论文,笔者分析近几年的来稿发现,高质量的论文往往科研设计比较规范,统计学方法正确,而大多数退稿的论文,其科研设计比较简单和粗糙,从而造成研究有明显的“硬伤”。在最终发表出来的论文中也有相当一部分是经过反复修改后才能见刊。为了帮助广大作者特别是年轻的临床医师提高论文撰写的水平,本文主要从临床科研设计方面总结和归纳一些常用的基本规范。

临床试验的定义
为了了解一定时期内某种临床操作方法、药物或仪器在某些患者中应用的临床效果,科研人员设计的一种前瞻性的试验方案,称之为临床试验(clinical trial)。高质量的临床试验需要严谨的设计才能获得。然而,有些临床研究由于其特殊性,只能进行观察性的研究(observational study),不在本文的讨论范围之内。此外,麻醉学论文常常涉及到麻醉药物的观察,可能是Ⅰ期、Ⅱ期或Ⅲ期临床试验,本文讨论的仅是Ⅲ期临床试验,即在患者身上所做的试验。
结局指标的定义和选择
临床研究所要解决或探讨的问题是通过观察干预方法(intervention)对某个关键指标的影响来分析的。通常这个关键指标被称为主要结局指标(primaryoutcome)。一般来说,主要结局指标只有一个,其他指标均为次要结局指标(secondaryoutcome)。例如,术后恶心呕吐发生率被设定为主要指标,那么术中麻醉药用量、手术时间、拔管时间等均可列为次要指标。有些作者在论文中会分析和探讨干预措施在某个亚组的影响效果,如男性患者或肥胖患者,那么这些亚组分析在研究设计时就应该被考虑到。然而,分析这些论文后笔者发现,在试验设计阶段,作者并没有考虑到要做亚组分析,仅仅是因为研究得出的主要结果没有统计学差异,但为了论文发表,作者不得不去做亚组分析,从而有可能得出阳性结果。但是,这样的亚组分析需要作者和审稿者格外注意,因为研究设计的检验效能只是针对主要结局指标,不能为亚组分析得出有意义的结果。而且,即使得出阳性结果,也很有可能是偶然因素造成。
主要结局指标的选择对临床试验的结果和结论至关重要。研究什么样的问题,选择什么样的指标,这些指标应该是行业内公知公认的。如对患者术后疼痛的影响,虽然VAS评分和NRS评分均为主观性指标,影响因素较多,但是用其评价术后疼痛强度被同行广泛接受。当然,如果能结合镇痛药物的使用情况进行综合分析,研究的结果将会更具有指导意义。因此,为了解释某些临床现象和效果,多个指标共同阐述研究的问题可能更加合理,同时也能减少需要的样本量。
不论选择哪个或哪些指标,在测量这些指标时应尽可能采用盲法和标准测量方法。相对于国外作者,国内作者在科研设计时尤其要注意采用标准测量方法和疗效判定标准,从而让研究的结果被同行认可,同时具有行业可比性,为循证医学提供有效证据。
患者纳入和排除标准
试验设计阶段,患者的纳入和排除标准应该被确切定义,并写入设计方案中。国际医学期刊编辑委员会(International Committee of Medical Journal Editors,ICMJE)推荐的医学论文撰写格式和规范(ICMJE Recommendations)中明确指出,患者的纳入和排除标准不仅要被写入方案中,而且应该发表出来,即在相关网站(如www.clinicaltrials.gov)进行注册和登记。国际医学期刊界一致认为,通过这样的方式,能够提高临床试验的透明度和结果的可靠性。因此,笔者建议国内的作者在临床试验方案确定后及时到相关网站进行登记,获取注册号,为研究论文能够在高质量期刊上发表提供保障。
纳入和排除标准必须具备可操作性,因为其影响了研究的结果能否被同行采纳(外部有效性)。如读者可能关心的是该研究的方法能否用于孕妇,能否被长期随访等。一旦确定了纳入和排除标准,作者需要根据拟研究的问题采取不同的随机化方法,如简单随机,分层随机,群体随机等。虽然患者随机选择的方法有多种,但作者仍然需要注意患者的代表性和可能产生的选择偏倚。“健康志愿者效应”表明,即时患者是自愿加入研究,他们仍有可能在某些方面与其他患者存在显著不同。
临床试验设计类型
根据所研究的问题不同,作者需要选择不同的试验设计类型。多数试验设计用来证明拟采用的干预措施优于传统方法或安慰剂对照,如平行组设计,交叉设计等。通常,对照组可以选择不接受干预措施(空白对照),安慰剂,或现有治疗方法。但是,当作者决定让患者接受空白对照时,需要注意伦理学问题。没有通过伦理批准的研究方案是不能被注册的。不管怎样,作者如果选择空白对照或安慰剂对照,在确定研究方案时必须给出合理的理由。
有研究表明,影响力较大的期刊更倾向于发表有阳性结果的研究,即发表偏倚。实际上,有些研究的目的并不是要证明两种方法哪个更好,而只是表明拟采用的干预措施不良反应更少,对患者更有益。不过,这样的研究设计对统计学方法的要求较高,作者需充分掌握相关知识,否则很难分析得出有说服力的结果。
样本量确定
国内发表的论文普遍存在样本量计算缺失的问题。样本量计算应该在试验设计时或预试验结束时就已经完成,并写入方案中。样本量计算的方法比较复杂,不在本文的讨论范围之内,但作者应该了解决定样本量的基本要件,包括主要指标的类型(连续性变量,二分类变量),检验水准(α),把握度(1-β),以及效应量(即两种方法对指标造成的差异大小)。需要提醒作者的是,并非每一项研究都要将所有拟纳入的患者进行干预,只要两种方法对主要结局指标造成的差异达到了预先确定的检验水准(通常P<0.05),就可以提前结束试验,避免不必要的浪费。同时,这些与原先方案不一致的内容应该在发表的论文中报道出来。
随机化方法
众所周知,患者随机选择不同的干预措施对研究结果具有极其显著的影响。国内已发表或未发表的论文中不做随机或随便进行干预措施的研究并不少见。随机等同于随便的现象时有发生。原因就在于很多作者对随机化的意义理解不够,或者在实际操作中觉得麻烦而未认真执行。归根结底是某些作者的科研态度不够端正,需要通过不断学习提高认识。
随机化的作用就是将患者间可能存在的混杂因素平衡在各个组中,从而避免干预措施对研究结果的判断。临床上常用的随机化方法有:简单随机,区组随机和分层随机。不同的方法有不同的应用环境,作者在做科研设计前应参考相关书籍或文献,对随机化的方法有个基本的了解。笔者在分析一些论文时发现,有的研究实际上采用的是分层随机,而不是简单随机的方法,但作者在论文中对具体细节只字不提,原因可能是作者对方法学的知识掌握不足。但有趣的是,国内作者撰写的动物实验论文中,随机化方法的描述却比较清楚,如具体描述如何做区组设计,这在临床试验论文中是很少见到的。
盲法
现代试验方法学认为,盲法与随机化和分配隐藏是不能分割的整体,都是为了保证试验的科学严谨,避免研究结果产生偏倚。没有盲法的研究,即使做了随机化分组,其结果通常都是被夸大的。根据设盲对象的不同,盲法通常可以分为:单盲,双盲和三盲。单盲是仅对患者盲,患者不知道自己接受何种干预措施,但由于操作者清楚干预措施的具体细节,因此往往造成试验结果倾向于研究者希望得到的结果。双盲是临床试验普遍采用的盲法,即对患者和操作者同时设盲,大大减少了两者对试验结果的主观影响。为了提高试验结果的可靠性,某些研究还会对测量人员或数据分析人员设盲,即三盲,更加提高了研究结果的可靠性,但是由于操作复杂,没有双盲使用的普遍。麻醉学论文中常见有主观性指标,如VAS评分,这样的研究如果不采用盲法,试验结果很可能存在测量偏倚。
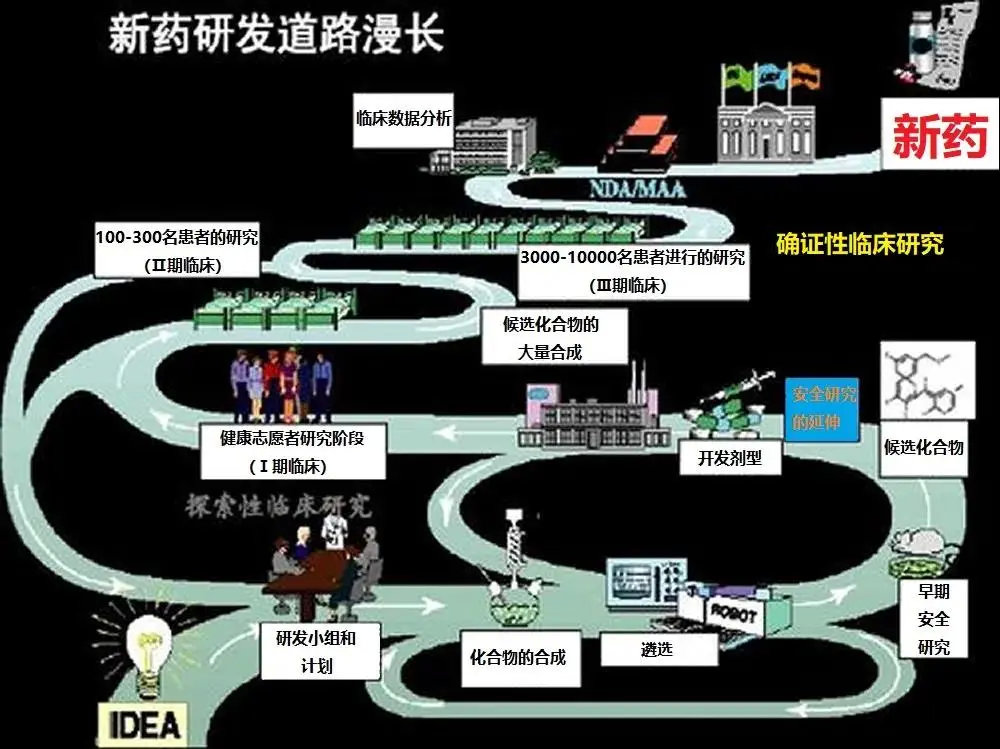
结果分析
在临床试验设计时,研究结果的分析方法应该已经确定。目前方法学上建议采用的是意向性治疗分析(intention to treat,ITT),即结果分析的人群是最初纳入的全部患者,如果有患者由于各种原因被剔除出组或改变治疗方案,在结果分析时依然将这些患者按照试验设计的方案进行分析,从而减少分析偏倚。充分随机化的分组设置平衡了各种因素,因此组间均衡可比。如果在试验结束时剔除一些患者,可能会造成组间基线不一致,失去可比性。
论文撰写规范
有研究表明,多达50%的医学论文在发表后存在多种撰写不规范的情况。国内医学论文的撰写质量也不容乐观。许多研究表明,国内医学论文的撰写质量与国外论文存在较大差距。原因可能是许多国际期刊已经在十多年前开始采用《临床试验报告的统一标准(CONSORT声明)》。有研究表明,CONSORT声明能够明显提高医学论文的报告质量。国内外医学论文或研究方案常见的不足主要体现在随机化方法交代不清,样本量计算缺失,未定义和描述主要结局指标等。因此,国内作者应该尽快熟悉CONSORT声明,了解临床试验报告的必备条目。此外,试验设计方案也已有统一的规范,即SPIRIT声明。作者如果能将两者结合使用,应该可以显著提高试验设计和论文撰写的质量。
小结
临床试验的成功实施需要研究者付出较多的时间和精力。广大医务工作者特别是年轻的医师应该学习掌握必备的科研设计和论文撰写的基本知识,从而提高临床研究的质量和论文撰写水平。可以根据自身条件,选择适合自己的临床科研课题,但科学、严谨、规范的试验设计才是高质量论文产出的有效保证。为了给我国医学科技的发展提供良好的循证医学证据,临g床科研人员应将有限的资源用于高质量的临床试验,从而推动整个医学技术的进步。
转自:药物与用药安全 公众号 2020年12月24日

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
行业资讯
知识分享









 豫公网安备 41010202003160号
豫公网安备 41010202003160号