美国:FDA更新Q-submission指导原则
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
近日美国食品药品监督管理局(FDA)更新了《医疗器械提交的反馈申请和会议申请:Q-Submission指导原则》。此文件是对2019版Q-sub指导原则的更新,更新的主要内容如下:
1. 增加了STeP医疗器械安全技术计划的Q-Sub形式;海河在1月8日发布的公众号文章已经和大家分享了FDA新的审核项目STeP。本次Q-Sub指导原则的更新也是为配套新的审核项目提供的新的反馈机制。
2. 增加了信息会议此类Q-Sub其他适用形式的举例。

虽然更新的内容很少。但是Q-Sub指导原则本身就是一份很重要的文件,它就不同的提交项目向申请人提供了与FDA进行沟通的可行机制。下面我们就来看一下,Q-Sub指导原则的几个重要的部分。
1、Q-Sub指导原则的适用范围
Q-Sub包含A,B,C,D 4种常见沟通类型。另外还有适用于FDA已发布的各种交互类审核项目的交互跟踪机制,我们称之为E类型沟通机制。除此之外的沟通项目,在FDA还未提供新的沟通机制之前,FDA建议使用信息会议的方式进行交互跟踪,我们称之为F类型沟通机制
2、Q-Sub类型
A. 预提交(pre-sub)程序
预提交程序指的是正式上市前申请文件提交前,申请者向FDA提供预审核资料,就某些具体问题提出反馈请求。该途径可以让FDA提前审核临床和/或非临床研究的方案以及其他可能的关键信息,申请人在获得FDA反馈后可以在研究方案中尽可能的考虑FDA的意见。这样可以有利于提高后面正式递交文件的质量。
适用的提交项目:
上市前申请包括临床实验器械豁免IDE, 上市前批注PMA,人道主义器械豁免申请HDE,自动评定类申请DeNovo request, 上市前准许510(k),Dual 510(k), 生物制剂许可申请BLA,实验性新药申请IND,附件分类请求,临床实验室改进修订(CLIA)豁免申请
B. 提交资料问题反馈请求(SIRs)
SIRs指的是在已提交正式文件并收到FDA的发补意见的情况下,申请人可以通过SIR与FDA沟通发补问题的解决思路,从而加快正式文件的审核进度。这个途径类似于我们国家的补正资料预审查机制。需要申请人注意的是,在SIR中,FDA仅会就问题解决思路提出反馈意见,而不会审核任何测试相关的数据以及问题的回复。
适用的上市前申请包括:
1)自动III类器械指定(De Novo request),上市前准许510(k),Dual 510(k)及实验室改进修订豁免申请项目中hold letter里的问题;
2)PMA和HDE项目中的重大缺陷、不被批准、有缺陷的批准、待批准的GMP和PAS条件的批准;
3)BLA申请的完全答复信函。
C. 研究风险确定
研究风险确定指的是申请人要求FDA确定处于计划中的医疗器械的临床研究是否为重大风险(SR),非重大风险(NSR)或可IDE豁免。对于非IDE豁免研究,申请人有责任进行初步风险判定(SR或NSR)并将其提交给机构审查委员会(IRB)。FDA可帮助申请人以及临床研究者和IRB进行风险判定,并可以最终裁决临床研究是重大风险还是非重大风险。
D. 信息会议
信息会议指的是申请人可以自愿通过会议的方式与FDA分享产品研发过程中的信息,从而使FDA熟悉这个新产品。因为只是分享的目的,所以并不需要FDA给出反馈。这个机制适用于在接下来的6~12个月内有多次提交计划的申请人。信息会议可以让FDA了解与当前可用技术存在重大差异的新设备。
信息会议还可以用于记录FDA和申请人之间的交互,但这种交互不属于本D沟通类型,而属于下文提到的F信息会议的另外一种使用方法。
E. 其他Q-sub形式
除了上面列出的4种Q-Sub类型之外,下列交互活动的跟踪也属于Q-Sub。这些交互活动的政策及程序可以在各自的指导文件中找到。
1)“交互程序100天会议及后续缺陷指导原则”中规定的PMA 100天会议;
2)“根据FDA现代化法案(FDAMA)进行的早期合作会议”指导原则中描述的协议和确定会议;
3)“突破性器械计划”指导原则中描述的与突破性器械计划相关的提交内容
4)“安全技术计划”指导原则中描述的与安全技术计划相关的提交内容
5)“医疗器械附件-描述附件和分类途径”指导原则中描述的附件分类需求
F. 信息会议的另外一种使用方法
一些不符合以上5个Q-Sub类型的特殊类型的交互方式,在FDA还没有为它们建立新的Q-Sub方式之前,FDA可能采用信息会议的方式跟踪这些交互。不同于D类型沟通方式,这种沟通机制是可以要求FDA提供反馈的。例如:
1)其他政府机构、非营利组织、贸易组织和专业协会就特定问题或跨领域政策事项(例如,与特定的上市前申请无关的提交策略,第三方测试实验室的非临床测试策略)向FDA提出反馈请求;
2)有关医疗器械开发工具的反馈请求;
3)有关认可可公开访问的遗传变异数据库的反馈请求;
4)有关临床研究的设计要素的反馈请求,并且这些反馈请求不属于Pre-sub的范畴。这些请求可能包括有关NSR或IDE豁免研究的研究设计的反馈,这些研究的结果并非旨在支持后续的IDE或上市申请。
5)FD&C法案第503(g)(2)(A)条所定义的组合产品协议会议(CPAM)。
6)与合规行为有关的FDA反馈请求。例如,信息会议Q-Sub可用于请求FDA给出FDA 483表中列出的检查观察项的反馈,以帮助申请人准备回复文件。
3、Q-Sub主要类型对应的反馈机制及时间线
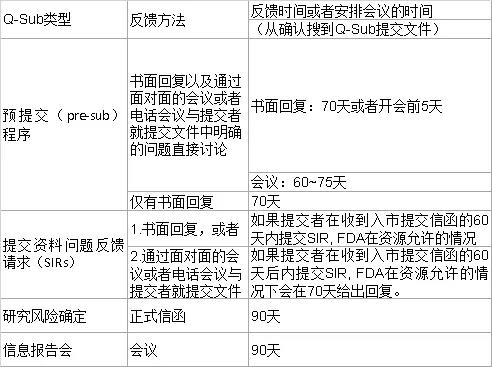
此外,还需要注意的是在这份新的Q-Sub的指导原则中,FDA给出的反馈时间表与之前的并没有差别。但是根据海河最近与FDA的沟通,为了应对疫情,FDA不得不将很多资源都分配给应对新冠病毒的相关业务上,所以从2020年10月份开始,FDA对于收到的Pre-sub的回复时间开始有普遍性的延迟,最快也要120天后才能对相关Pre-sub文件进行实质审核。


站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
行业资讯
知识分享









 豫公网安备 41010202003160号
豫公网安备 41010202003160号