医疗器械进入北爱尔兰市场有什么要求?需要MHRA注册吗?
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
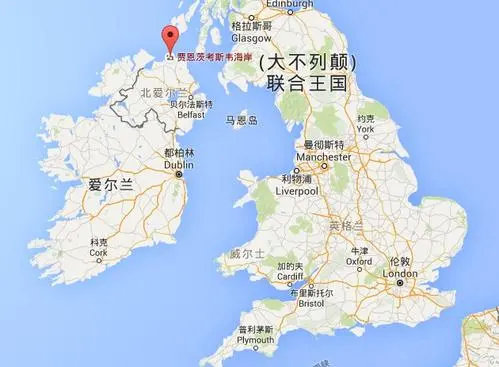
英国的全称是大不列颠及北爱尔兰联合王国(UK),包含了大不列颠(GB)和北爱尔兰(NI)两个区域。从上图可以看出,北爱尔兰和爱尔兰接壤。
英国脱欧带来许多棘手的问题,其中之一就是如何处理北爱尔兰与爱尔兰(欧盟成员国)之间的跨境贸易。因此,制定了一个从监管角度区别对待北爱尔兰和大不列颠(英格兰,威尔士,苏格兰)的计划,即使所有四个地区都属于英国。
这是努力防止爱尔兰与北爱尔兰之间的“硬边界”的副作用。
北爱尔兰市场的合格评定
北爱尔兰市场接受CE标志和UK(NI)标志,但是不单独接受UKCA标志。
1、对于非北爱尔兰地区的制造商,如果产品要出口到北爱尔兰,那么你需要满足CE认证的要求。通常应该向欧盟公告机构申请CE认证,获得证书后才可以出口到北爱尔兰。其对于MDD和MDR,IVDD和IVDR的转换安排和欧盟同步。
2、对于北爱尔兰的制造商,可以申请英国获批准的认证机构进行认证,获得UKNI证书,在爱尔兰合法销售。而UKNI的标志只能用在北爱尔兰市场,既不会被欧盟市场接受,也不会被大不列颠市场接受。
进入北爱尔兰市场需要MHRA注册
由于MHRA只受理英国制造商或者是位于英国的法规负责人(UK Responsible Person)的注册申请,那么位于英国境外的制造商如果要进入北爱尔兰市场,需要指定英国法规负责人来完成MHRA注册。
有一种情况例外,那就是你的欧盟授权代表是位于北爱尔兰地区,那么就不需要额外指定英国法规负责人,可以由北爱尔兰地区的欧代完成MHRA注册申报。
是否需要欧代和英国法规负责人
对位于欧盟,英国(大不列颠或者北爱尔兰),世界其他区域的制造商,当他们的产品分别投放到欧盟、大不列颠和北爱尔兰市场时,是否需要指定欧盟授权代表并且完成注册,或者是需要指定英国合规负责人并且完成MHRA注册?其中涉及的情况比较复杂,请参考下图(拖出查看大图):

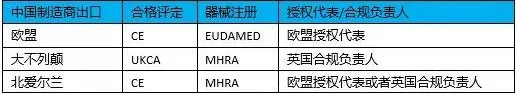
对于中国的制造商而言,如果你指定了欧盟授权代表和英国合规负责人,那么不论你的产品是到欧盟,大不列颠还是北爱尔兰,都可以满足要求。
结语
针对上述情况,我们对于中国制造商出口需要满足的要求进行汇总如下:

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
行业资讯
知识分享









 豫公网安备 41010202003160号
豫公网安备 41010202003160号