GCP新规下,如何高效管理SAE个例报告?
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
2018年,4.27公告发布,彼时的申办方满眼尽是“昨夜西风凋碧树。独上高楼,望尽天涯路”,不知药物警戒前路为何。然而,历经两年的摸索,大家已然做到了“衣带渐宽终不悔,为伊消得人憔悴”的境界,处理PV事务熟练而专业。此次新版GCP的发布,虽然是7月1日才正式生效,但在日常和申办方的沟通中已满满地感受到申办方“众里寻他千百度。蓦然回首,那人却在,灯火阑珊处”的态度。新版GCP,起到的作用是承前启后的,既是对4.27公告的承接,也为还在草案中的中国版《药物警戒质量管理规范》(GVP)奠定基调,使中国的临床试验研究进一步与国际接轨。
新版GCP对于申办方的影响是全方位的,就SAE个例报告处理方面,强化了申办方的主体责任,细化了申办方对SAE的管理流程。在此,我们详细解读,在新规之下,该如何高效、合规的处理SAE。
新旧法规下SAE报告处理流程对比
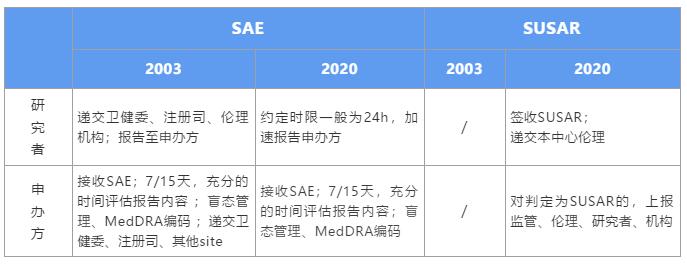
现行GCP(03版)法规下的SAE报告业务逻辑是以研究者和申办方为双核,共同进行SAE报告的管理:研究者将SAE报告提供给申办方之余,还需将报告递交至卫健委、注册司、伦理;申办方收到SAE报告后进行严重性、预期性、相关性的判断,若是susar应于7-15天内以XML格式、Gateway方式递交CDE,同时将SAE报告递交至卫健委、注册司、机构等。这中间存在一定的重复、交叉报告。新版GCP则着实减轻了研究者的负担,突出申办方对SAE管理的主体责任,此时研究者只需将SAE报告报告至申办方,无需再递交其他监管部门,但需要强调的是,研究者应该签收申办方发来的SUSAR报告。申办方则是任重而道远,需将评估后的SUSAR报告递交至CDE、伦理、机构、研究者。双方职责变化如图表所示:
实际操作问题解答
1、SAE信息采集需要用什么样的表格?
申办方承担SAE管理责任,需要以更细致的E2B R3版SAE表进行信息收集。例如,表格的内容可以包括:研究项目信息(研究题目、分期、盲态、项目代号)、辅助评估字段(CTCAE分级、去激发、研究者获知SAE发生时间)、主体内容信息(E2B R3字段)、报告状态信息(首次/随访、任务倒计时)。
2、盲态试验中SUSAR分发的注意点?
向CDE递交的是“确认的”揭盲后的SUSAR报告,而向伦理、机构、研究者分发的是“疑似的”复盲的SUSAR报告(PDF或纸质文档)。在临床试验过程中,建议申办方将所有SAE汇总到一个PV系统统一管理。一方面,方便递交各个部门,另一方面,便于汇总报告的撰写,如DSUR撰写。
3、如何确保研究者本人签收报告?
“签收”是一个很难界定的行为,如果申办方以快递的方式邮寄给研究者,无法保证是研究者亲自签收;若是通过邮件发送,亦无法保证研究者查看了邮件。是否有一种方式既能保证是研究者签收又能帮助研究者快捷的完成伦理的递交?思途器械CRO提供SAE管家模式,可以满足研究者签收的合规要求,也可以满足首次录入即符合E2B R3标准,助力申办方玩转SUSAR分发。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
行业资讯
知识分享









 豫公网安备 41010202003160号
豫公网安备 41010202003160号