新版医疗器械监督管理条例对肿瘤NGS基因检测有何影响?LDTs还远吗?(新规必看)
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
来源:基因talks
肿瘤NGS基因检测将何去何从?
*注:本内容仅作方向参考,具体以官方政策为准!
2021年3月18日,国家药品监督管理局(NMPA)发布最新《医疗器械监督管理条例》(国务院令第739号),并自2021年6月1日起施行,对肿瘤NGS基因检测有何影响?
医疗器械,是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件(基本是二类)。所以肿瘤NGS基因检测试剂盒是一种分子遗传检测类体外诊断产品(IVDs)归属于三类医疗器械,其监管由国家药品监督管理局(NMPA)负责,管理法规是以国务院令形式发布的《医疗器械监督管理条例》。
回到肿瘤NGS基因检测,是不是说严格按照IVDs进行监管呢?不是的,这与国情也有关系,这些年,中国肿瘤NGS基因检测产业处在市场兴起的初中级阶段,监管制度还十分不完善(此前我国对LDTs项目尚没有明确的政策、法规与监管措施,可以认为是监管灰度区),所以大家都在打着LDTs(实验室自建检测)的口号开展临床肿瘤NGS基因检测服务。当然,肿瘤NGS基因检测以LDTs的形式得以应用是有利于推进我国个体化医学和精准医学的临床应用和发展。但是,带来的一个问题就是:乱!鱼龙混杂!良莠不齐!以及无序的竞争!
那么,LDTs开展是否会建立行业标准和规范,实施监管呢?(此前已有城市开始试行LDTs,比如广东省和江苏省,但均不是国家层面)是否会创造公平有序的竞争环境呢?这是大家这几年一直在讨论的话题:合规化!
2018年,有人发出:“肿瘤NGS基因检测行业三年内必将洗牌”的呼声,如今三年期限已到,肿瘤NGS基因检测行业离洗牌还有多远?
先说,IVDs
IVDs(InVitro Diagnostic devices),即体外诊断产品,是指在人体之外,通过对人体样本(血液、体液、组织等)进行检测而获取临床信息,进而为用于疾病诊断或包括为治疗或预防疾病确定患者健康状态的其它目的的试剂、仪器和系统,并作为商品销售。
在国内,IVDs的监管是由NMPA负责,管理法规是以国务院令形式发布的《医疗器械监督管理条例》。同样,IVDs按低、中和高风险分为三类:
第一类:实行产品备案管理;
第二、三类:实行产品注册管理,二类由省级药监部门负责注册,三类由NMPA负责注册;
肿瘤NGS基因检测试剂盒(分子遗传检测)属于三类(医疗器械)!NMPA负责注册!
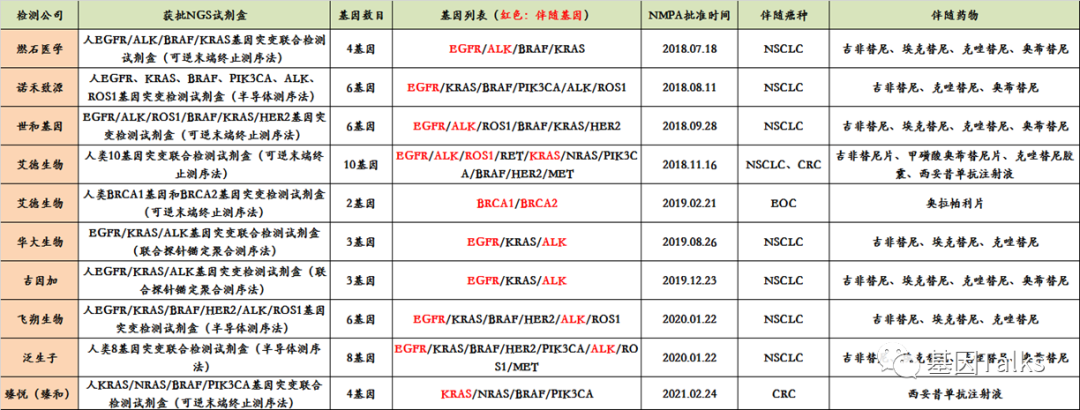
所以,注重合规的肿瘤NGS基因检测公司都在积极布局IVDs注册(三类)。可是即便如此,截止到目前,国内也仅有10款肿瘤NGS-IVDs产品获批,且均为基于组织或血细胞的NGS小panel(2-10基因),针对的癌种单一,如肺癌,结直肠癌或卵巢癌,无法满足偌大的市场或临床需求,因为当前肿瘤NGS-IVDs产品面临的一个现状就是“获批即落后”。
此外,如果肿瘤NGS基因检测公司修改了NMPA注册或批准的试剂或检测系统(比如改变了试剂组成,改变了临床预期用途(比如将“辅助诊断”改为“早筛”,NGS基因panel扩大等),数据库的升级等),那么它就不是IVDs产品了。
所以,NMPA批准的这些肿瘤NGS-IVDs试剂盒还是当初的那个“少年”嘛?(大家自行判断)如果不是,它变成了什么?没错,就是LDTs!
再说,LDTs
LDTs(Laboratory Developed Tests),即实验室自建检测,是指医学检验部门自行研发、验证和使用的检测方法,仅在医学检验部门内部使用,不作为商品出售给其它医学检验部门、医院及个人。
在美国,LDTs是指在CLIA认证的实验室内研发的用于患者疾病诊疗的检测方法和试剂,仅限于研发该LDTs的实验室使用。在CLIA规则下定期进行检查,确保LDTs遵循必要的程序,并且LDTs检测只能是在执业医生、实验室科学家、遗传学家和分子病理学家等实验室专家的指导下进行。

美国对LDTs有着较为明确的监管措施,并且与医保制度相关,而我国对LDTs项目尚没有明确的政策、法规与监管措施。国内针对LDTs在2000年发布的《医疗器械监督管理条例》(国务院令第276号)中的第十条规定:医疗机构根据本单位的临床需要,可以研制医疗器械,在执业医师指导下在本单位使用。随后,2014年新发布的《医疗器械监督管理条例》(国务院令第650号)删除了这一条,但并没有规定不允许自制医疗器械(肿瘤NGS基因检测监管的灰度区)。

肿瘤NGS基因检测以LDTs的形式得以应用有利于推进我国个体化医学和精准医学的临床应用和发展,但是经过几年的发展,大家可以发现市场一片乱象,都在打着LDTs的口号开展临床肿瘤NGS基因检测服务。故此,我国LDTs或将迎来新一轮监管。
2021年3月18日,国家药品监督管理局(NMPA)发布最新《医疗器械监督管理条例》(国务院令第739号),并自2021年6月1日起施行。其中,第五十三条规定:对国内尚无同品种产品上市的体外诊断试剂,符合条件的医疗机构根据本单位的临床需要,可自行研制,在执业医师指导下在本单位内使用。具体管理办法由国务院药品监督管理部门会同国务院卫生主管部门制定。

LDTs终究还是来了,虽然有点晚!
最新的《医疗器械监督管理条例》(国务院令第739号)新增了LDTs的规定,在LDTs合规的同时亦会带来监管,势必会带来新一轮的“洗牌”,具体的LDTs管理细则大家还是期待下吧(比如,无同品种产品怎么界定?怎么样算同品种产品?产品临床需要的标准是什么?符合条件的医疗机构是如何认定的?自行研制对实验室规格,对人员,还有性能(确认)等要求是什么?执业医师是本机构还是外部人员?本单位内使用?等等),我们不作过多的揣测(皮包公司肯定是难了,因为涉及到OEM报告盖章及责任人的问题;LDTs开始前期可能会有一个过渡期,但是细则大概率是出来了),具体管理办法将由国务院药品监督管理部门会同国务院卫生主管部门制定。
最后,规范化监管,几家欢喜几家愁
我们都知道,肿瘤NGS基因检测是日新月异的检测产品,比如基因检测panel的临床应用(从单基因到多基因的趋势),临床诊疗指南的不断更新,生物标志物的不断涌现(如TMB,HRD,MRD等),检测技术的不断出现等,都决定了肿瘤NGS基因检测更适用LDTs的管理办法,这时候LDTs的政策、法规与监管措施就显得尤为重要(可能是通过认可实验室能力的途径来管理)。

LDTs国家层面的规范化监管,势必将带来两极分化,几家欢喜,几家愁。即实验室配置齐全,检测方法学成熟,SOP质量管理体系完整,具备生信分析能力的实力企业将进一步扩大自己的优势,继续领跑,反观一些“小作坊”公司,可能将在LDTs的规范化监管过程中逐渐掉队甚至是被淘汰。
肿瘤NGS基因检测公司普遍盈利不佳,亏损亦是常态,如果规范化监管来临(以及不确定的新冠肺炎疫情),该怎么办?我想先考虑活下去撑到最后才是关键。市场没有眼泪,强者恒强,而弱者只有忍辱负重,蛰伏前行,当然也不排除“弯道超车”的可能。
从目前发展局势来看,肿瘤NGS基因检测行业不可能再是百花齐放的景象,但也不可能是一枝独秀的景象,而是两枝,三枝,甚至更多...祝大家越来越好!
最后,再给大家带来一个好消息和一个坏消息,好消息就是本次《医疗器械监督管理条例》(国务院令第739号)鼓励行业创新发展,将医疗器械创新纳入发展重点,对创新医疗器械予以优先审评审批;并且在融资、信贷等方面予以支持,利好!

坏消息就是本次《医疗器械监督管理条例》(国务院令第739号)加大了惩处力度,提高了违法成本,一不小心就可能终身禁业,钱财两空!

参考资料:
1.https://www.nmpa.gov.cn/xxgk/fgwj/flxzhfg/20210318084145148.html

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
行业资讯
知识分享









 豫公网安备 41010202003160号
豫公网安备 41010202003160号