GMP、GLP和GCP是什么?有什么区别?
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次

GMP、GLP和GCP是什么?
GMP(GOOD MANUFACTURING PRACTICE)
良好生产规范:世界卫生组织将GMP定义为指导食物、药品、医疗产品生产和质量管理的法规。GMP要求制药、食品等生产企业应具备良好的生产设备,合理的生产过程,完善的质量管理和严格的检测系统,确保产品质量(包括食品安全卫生)符合法规要求。对此标准的监督与实施是由FDA来执行。
GLP(Good Laboratory Practice)
药物非临床研究质量管理规范:药物的非临床研究是指非人体研究,亦称为临床前研究,用于评价药物的安全性,在实验室条件下,通过动物实验进行非临床(非人体)的各种毒性实验,包括单次给药的毒性试验、反复给药的毒性试验、生殖毒性试验、致突变试验、致癌试验、各种刺激性试验、依赖性试验以及与药品安全性的评价有关的其他毒性试验。我国的《药品非临床研究质量管理规范》于1999年发布并于1999年11月1日起施行。对此标准的监督与实施是由FDA来执行。
GCP(Good Clinical Practice)
药品临床试验管理规范:规范药品临床试验全过程的标准规定,其目的在于保证临床试验过程的规范,结果科学可靠,保护受试者的权益并保障其安全。GCP不但适用于承担各期(I--IV期)临床试验的人员(包括医院管理人员、伦理委员会成员、各研究领域专家、教授、医师、药师、人员及实验室技术人员),同时也适用于药品监督管理人员、制药企业临床研究员及相关人员。对此标准的监督与实施是由FDA来执行。
FDA/USP/GxP关系梳理
USP是产品与检测方法的标准。FDA对药品和营养补充剂的管理引用部分USP标准。但不是所有USP标准都是被法律化的。FDA负责监督和实施GxP的执行。
GMP、GLP和GCP的区别
制药业重要规范统称药品GxP,包括常见的GMP、GLP和GCP-以下分析三者区别:
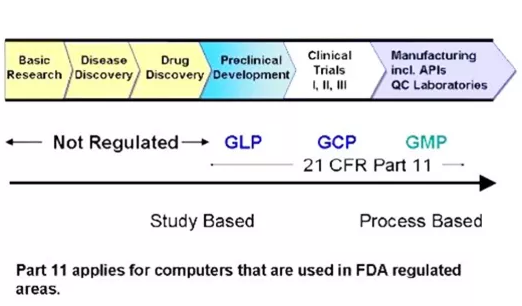
在GMP、GLP和GCP的规范下,药品的质量可控性、安全性和有效性由各项试验得到充分证据,注册申报通过审查,药品被批准上市。目的达到,交集完成了使命。非临床研究不再,GLP就结束了;如果有上市后临床试验,GCP必不可少;只要产品不撤市,生产继续,GMP就无止境。
推荐服务:
GMP体系建立辅导服务

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
行业资讯
知识分享









 豫公网安备 41010202003160号
豫公网安备 41010202003160号