植入式左心室辅助系统注册技术审查指导原则(2020年第17号)
发布日期:2020-03-10 阅读量:次
附件:植入式左心室辅助系统注册技术审查指导原则(2020年第17号).doc
植入式左心室辅助系统注册技术审查
指导原则
本指导原则是对植入式左心室辅助系统的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化。申请人还应依据具体产品的特性确定其中的具体内容是否适用,若不适用,需具体阐述其理由及相应的科学依据。
本指导原则是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其它方法,也可以采用,但是需要提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。本指导原则也可作为其他心室辅助系统的审查参考。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
一、范围
本指导原则适用于植入式左心室辅助系统。适用范围分为如下两种情形:
用于非长期治疗系统的适用范围为:用于为进展期难治性左心衰患者血液循环提供机械支持,含心脏移植前或恢复心脏功能的过渡治疗。供具备心脏移植条件与术后综合护理能力的医疗机构使用,医务人员、院外护理人员以及患者须通过相应培训。抗凝治疗不耐受患者禁用。
可用于长期治疗系统的适用范围为:用于为进展期难治性左心衰患者血液循环提供机械支持,即心脏移植前或恢复心脏功能的过渡治疗以及长期治疗。供具备心脏移植条件与术后综合护理能力的医疗机构使用,医务人员、院外护理人员以及患者须通过相应培训。抗凝治疗不耐受患者禁用。
二、综述资料
(一)概述
产品管理类别为三类,属于《医疗器械分类目录》有源植入器械中的植入式循环辅助设备,类别代号为12-04-02。按照装置的原理和结构可分为搏动泵、轴流泵(如机械轴承轴流泵)、离心泵(如磁液悬浮离心泵、流体动力轴承离心泵、全磁悬浮离心泵)等类型。概述中应阐述产品名称确定依据。
(二)产品描述
1.作用机理:描述产品作用于人体的基本原理和预期作用,如产品用于心衰患者为其提供血流动力学支持,支持期间可分担左心室的部分或全部的负荷,从而改善患者血液的全身灌注并减轻患者生理的不适。
2.工作原理:描述产品的基本工作过程,包括血泵原理(如血液泵叶轮的支撑情况和驱动情况,通过叶轮如何将进入泵内的血液排出等)、与心血管系统的连接情况、供电系统供电原理及控制单元控制原理。
3.系统组成及结构
(1)给出系统的设计依据、系统配置、系统组成结构以及操作限制的详细说明。关键设计选项的基本原理,包括但不限于对血液成分破坏最小化的方法、热量管理方法、驱动装置的选择、电源管理方案、可靠性研究、解剖构造适当性、与患者交互作用。
植入式左心室辅助系统通常包括植入式组件、体外组件及配套手术用工具等,应给出各个部件的尺寸、形状、重量和体积以及可以使用的系统组件的不同配置。其中:
植入式组件通常包括:血泵(结合图示详述包括叶轮、电机、电路板等泵内部件工作情况及工作原理)、心室与血泵入口连接部件(包括入血管(如适用))、血泵出口连接部件(包括出血管)、血泵经皮电缆线等。
体外组件通常包括:体外控制和监视装置、可充电电池/紧急备用电池、适配器、充电器、淋浴包、其他特定功能组件(如纯水密封组件)(如适用)等。
配套手术用工具通常包括:用于左心室开孔、辅助固定或夹持、皮肤穿刺的配套手术工具(如隧道刀、穿孔器、手术扳手、解剖器等)。
(2)给出系统总体框图、主要部件图示、各个部件工程图示(如二维投影图、剖视图或三维爆炸图等)及对应说明,并注明部件灭菌状态及是否为植入部件。
(3)列出各个部件的物理特性:尺寸、质量等。
(4)系统在不同使用环境下(如手术过程、医院、家庭、车载)的系统配置,应列出不同配置的组成,包括选配部件。
(5)与系统配套使用的医疗器械,但不作为拟申报注册的产品组成部分(如人造血管),应注明配套医疗器械的注册证信息(包括产品名称、型号规格、注册人名称等)和关键技术参数等信息。
(6)植入部件、与人体血液和组织接触的部件和涂层,应注明部件材料化学名称、材料厂家、接触部位和接触时间。高分子材料应提供CAS号码;金属材料应提供牌号及符合的标准(如适用);如使用添加剂(如色母料),应提供添加剂重量及占原材料重量百分比。如有其他直接影响产品安全性、有效性的组成材料相关内容,也应详细明确具体要求。
4.系统功能描述
给出系统的功能描述,包括各部件的全部性能范围,一些不希望在临床上使用或会导致装置失效的操作条件也应做描述。
(1)植入式组件功能描述:血泵功能描述中应明确血泵植入位置(腹腔或胸腔)及解剖构造适应性分析;提供运动部件(如:电机)的驱动、控制方式及设计原理;提供电机最低、最高限制转速等操作限制的说明;提供血泵设计工作范围(如设计转速、流量、功耗、扬程范围等)和误差范围;提供血泵(入口、出口)与血液循环系统连接的方式或原理;提供驱动电缆设计;提供血泵热能管理设计;提供血泵的密封设计,如:血泵内部组件与血液/体液的密封设计,防止血液渗漏的密封设计等;其他部件的功能描述。
(2)体外控制和监视装置功能描述:体外控制和监视装置功能概述;与血泵、供电部件连接设计,防止错误连接的措施;用户界面;报警信息及报警触发条件等。
(3)配套手术用工具功能描述:各手术工具部件的功能概述;在植入手术期间的基本操作方式及注意事项。
(4)系统供电部件描述:提供系统在不同环境下(手术过程、医院环境、家庭环境等)的供电配置和特殊要求;提供不同供电配置条件下更换电池(电源)的操作及注意事项,如:从双电池模式切换为单个电池和适配器供电等;提供充电器使用要求。
(5)系统其他组件的功能描述。
5.区别于其他同类产品的特征内容
应列举国内外同类产品情况,从产品基本原理、组成结构、性能要求、主要功能、使用方法、临床应用情况等多方面进行对比并进行说明。
6.储存运输、使用环境要求
(1)列出系统或各部件的储存运输、使用环境要求,包括但不限于温度范围、相对湿度范围、气压范围等。
(2)说明系统可安全使用的范围(如医院、家庭、公路等)。
(三)规格型号
对于申报的多种规格型号的产品,应当:
1.列出产品型号,描述各型号主要功能模块及其组成部件,提供图示说明。
2.描述并列出不同型号之间的差别。
(四)包装说明
描述有关产品(包括无菌部件和非无菌部件)包装的信息,以及与该产品一起销售的配件包装情况,对产品包装信息的内容应符合GB 16174.1-2015及ISO 14708-5:2010的要求。
应描述产品灭菌方法,并提供与灭菌方法相适应的初包装材料的信息。
应提供在宣称的使用期限内及运输条件下,保持包装完整性的依据。
(五)适用范围和禁忌症
1.适用范围:应当明确产品的适用范围或适应症;明确对产品使用的机构和人员的要求及应当具备的技能/知识/培训;说明系统中各组件是一次性使用还是重复使用;说明预期与其组合使用的器械。
2.预期使用环境:该系统一般情况下预期使用的地点包括医疗机构、救护车、家庭等,应将产品使用于安全的环境中,详细说明使用环境条件及保管环境条件。应避免在温度、湿度极端变化的地方和阳光直射处进行使用及保管。
3.适用人群:目标患者人群的信息(如成人等),患者选择标准的信息,以及使用过程中需要监测的参数、考虑的因素,如电源管理和报警管理等。
4.禁忌症:应当明确说明该系统的绝对禁忌症和相对禁忌症(若有)及其他禁止事项,说明禁止同时使用的医疗器械和相应应用情况(如不能进行MRI诊断或高压氧治疗等)。
(六)参考同类产品的信息
应列举国内外已上市同类产品情况,阐述申请注册产品的研发背景和目的。对于同类产品,应当说明选择其作为研发参考的原因。从产品基本原理、组成结构、性能要求、主要功能、使用方法等多方面进行对比并进行说明。
(七)其他需说明的问题
对于已获得批准的部件或配合使用的附件,应当提供批准文号和批准文件复印件;预期与其他医疗器械或通用产品组合使用的应当提供说明;应当说明系统各组合医疗器械间存在的物理、电气等连接方式。
三、研究资料
(一)产品性能研究
应当提供植入式左心室辅助系统性能研究资料以及产品技术要求的研究和编制说明,包括功能性、安全性指标(如电气安全与电磁兼容、辐射安全)以及与质量控制相关的其他指标的确定依据,所采用的标准或方法、采用的原因及理论基础。
1.系统性能测试
系统性能测试是在模拟的使用环境下对最终系统设计的一个全面的评价,应符合ISO14708-5:2010的要求并给出与该标准的对照表,明确适用性及不适用理由。
系统性能测试使用的装置应合理地反映预期的患者人群特征,包括心率、心排量、平均心房压(心室前负荷)、平均主动脉压(心室后负荷)、血管顺应性等。应当列出体外测试系统的试验设置值,包括压力、顺应性、被测试设备在测试系统中的位置及连接方式、测量部件的位置、试验设置的基本原理。另外,应包括系统所有时变参数的特性描述,这些参数与处于搏动环境的自然心脏同时(或作为一个替代物)起作用,通过这种方式,可以模拟出系统与患者间的性能影响。
性能评价可采用血液或模拟血液溶液。为了反映泵的性能,模拟血液溶液应模拟出血液的关键特性,如粘度、温度、密度等。测量的参数包括但不限于以下内容:血液泵输入和输出压力波形;血液泵输出流量波形;血泵产生的平均流出压力;向血泵输送的平均流入压力;平均泵流出量;可实现的最大操作限制。
为了全面评价产品性能和产品与患者之间的相互作用,应该进行以下两项测试:
(1)系统常规性能评价
测试装置设置为患者的常规生理条件,将产品接入该装置以常规参数和条件运行,系统整体需能够达到正常的血流动力学指标,如系统总流量、平均主动脉压、平均心房压等。
(2)极端条件下的系统响应和效应
测试应当模拟系统性能变化对患者的影响以及患者状态变化对系统性能的影响,确定出器械及患者极端操作的影响。极端操作包括最小血液流量、最大血液流量、高血压、低血压、流量及压力发生变化时的反应、可能的流入量/流出量限制。系统性能变化的极端条件包括输入功率、泵流量、压力、电池寿命等不利情况。
2.组件性能评价
(1)血泵的设计性能评价 通过泵设计性能评价泵的设计是否满足性能规范要求。
①流体动力学分析
申请人应提供血泵流体动力学分析的研究资料。流体动力学分析是对血泵内的流体动力学特性进行评估,并研究其结果与设计指标、体外测试、体内测试结果的关系。流体动力学分析的研究方法可以采用计算流体动力学(CFD)或流场可视化工具(PIV)等。
②气蚀
在任何工作条件下,血泵都不应出现气蚀现象。应提供临界气蚀条件及相关的研究资料(如适用)。
③血泵性能测试
通过水力学测试研究血泵主要性能参数(流量、扬程、转速、功率等)之间的关系,从而验证血泵设计满足其设计指标的要求。测试液体应使用血液或模拟血液溶液以模拟血液的关键特性,如粘度、温度和密度(如适用)。
④血泵抗重力加速度和扭摆性能评价
对于采用磁悬浮或其它非接触式轴承的血泵,其工作时动子和定子无机械接触,设计时应考虑在一定的重力加速度下或一定的角速度扭摆的情况下,系统依然保持设计要求。
应同时考虑血泵自振和谐振的情况。
应提供抗重力加速度和扭摆测试水平的定义依据,以及验证测试报告(如适用)。
(2)体外控制、驱动和监视装置
由患者携带的血泵控制、驱动装置以及体外监视装置应验证其满足设计指标,且应考虑其预期使用环境(如医院、家庭和救护车)。申请人应提供至少以下内容的验证资料:电气输入(电压范围、电流范围、纹波、电源要求);电气和/或机械输出(电压、电流、功率、扭矩、压力等);应符合GB9706.1-2007中对生命支持系统规定的电气安全要求;控制和、驱动单元和监视装置中使用的软件应符合《医疗器械软件注册技术审查指导原则》的要求;报警应符合YY0709-2009的要求,并包括多种类型的报警(例如听觉、视觉等);应考虑温度、振动、冲击等环境测试,可按照GB/T 14710-2009及申请人规定的测试方法进行测试;温升应符合GB9706.1-2007的规定。
(3)可植入控制和驱动部件(若有)
应符合GB16174.1-2015,提供相应的研究资料。
(4)电源
左心室辅助系统的电源(包括电池充电器)应符合GB9706.1-2007中规定的医疗设备的安全要求。需对电源输入和电源输出(电压范围、纹波、电流及电源)以及过载能力和过载保护进行验证。应说明预期使用环境(如医院、家庭和救护车)的测试要求。
应提供带有线路电源供给系统以补充或替代电池电源系统。若包含线路电源供给系统,需考虑以下情况:若电源失效,紧急电源的启动流程;标明电线连接及电源输出的电源状态指示器;若出现电线断开和/或电源失效,应有声响警报;电源冗余器械在医院内和医院外使用时,有线电源供给系统应符合GB9706.1-2007中的电源安全性要求。
(5)电池
由电池供电的左心室辅助系统应考虑进行以下测试:
①电池从满电量到耗尽状态的电压变化;
②电流(负载)对电池性能(电压、电量、外壳温度)的影响;
③时间、温度、负载和循环次数对电池容量的影响(老化);
④电池预防性维护和更换计划(基于循环次数或使用时间);
⑤如果电池发生故障的应急备份程序;
⑥充电规格参数:充电电流、充电结束条件、充电时间等;
⑦测量电池耗尽的方法;
⑧充电时潜在产生的气体危害的控制方法;
⑨电池状态指示灯,用来给出电池电量耗尽预警。申请人应定义从给出电池电量耗尽预警到电池停止给设备供电的时间间隔;
⑩电池耗尽时的听觉、视觉报警;
⑪电池电源并联冗余设计的适用性;
⑫放电超温的测量和识别方法;
⑬防止电池爆炸;
根据产品设计和临床医用条件,应提供能够证明电池安全的第三方认证证书,提供满足以下标准的验证资料:
GB 31241-2014,《便携式电子产品锂离子电池盒电池组安全要求》
IEC 62133:2013,《含碱性或其它非酸性电解液的蓄电池和蓄电池组—便携式密封蓄电池和蓄电池组的安全要求》
UN38.3,联合国关于危险品运输的建议、手册及试验标准,第6次修订版。
(6)连接器和驱动线缆
①电气连接
所有与电源、电池、控制器和血泵连接的电气连接的设计应进行以下的测试(如适用):拉力测试、扭力测试、挠曲测试、坠落测试、渗透测试及振动测试,并测量连接的电气/机械完整性、抗腐蚀能力、正确的连接器对接、连接器的连接/断开循环及各试验前和试验后的传导性/电阻,确保符合设计规范。应满足GB16174.1-2015中的要求。
②带有流体驱动的管路(若有)
对于带有流体驱动管路的系统,所有与驱动源和血泵连接的驱动管路都应考虑按照设计的指标进行拉力、扭曲、跌落、振动、弯折(弯曲半径)和磨损测试,并且测试后根据申请人的接受项目和指标检查驱动线缆的破损情况、泄漏及压力下降情况。
③人造血管、入口插管、心室连接器
人造血管若采用已有注册证的产品,应明确配用的人造血管的注册信息;若该部件由申报企业生产,应按照该部件的相应法规要求提供相应资料,其中应包括提供符合YY0500-2004要求的检测报告。
入口插管以及与血泵连接用的心室连接器应能够承受工作时产生的负压而不会塌陷或使空气进入血液流道。测试时要考虑血泵所产生的最大负压。
通过一定的测试评估与血泵和血液流道之间的所有连接是否符合指标要求,例如拉力、扭曲、振动、弯折(弯曲半径)和密封完整性等测试。
(7)人工心脏瓣膜
如果心室辅助装置中包含有人工心脏瓣膜,则人工心脏瓣膜的可靠性应放在最终的装置中进行评价,若瓣膜的设计无法在最终的装置上进行评价,则应详述理由,并按照该部件的相应法规要求提供相应资料,其中应包括提供符合GB 12279-2008要求的检测报告。
(8)经皮能量传输系统
经皮能量传输系统(TETS)将能量经过皮肤传送到体内的植入系统,而不需要使用穿透皮肤的电线或管路。该系统的验证应包括理论分析和测试。如果使用TETS,应提供指标定义的依据以及相应验证及检测报告。
指标应至少包括以下可测试参数:输入功率范围;输出功率范围;最大功率范围;效率;局部温升;工作电压范围;轴向/径向线圈偏心的影响;附近大的金属物体的影响;特定吸收率;双向信息的传输;信息传输失败的风险;频率范围;组织创伤(例如磨损、压力、皮肤损伤)。
(9)手术工具
应提供手术工具的性能研究资料,包括功能、物理特性、耐腐蚀性等。
3.可靠性
该产品的可靠性目标取决于机械循环支持装置的预期用途,一般来说,系统可靠性为系统在给定条件下在一定时期内执行功能的可能性。可靠性目标可以定义为:系统Z年内,在置信度为Y的条件下,可靠度达到X。
可靠性试验样本量可以基于左心室辅助设备的预期工作时间以及可靠性和置信区间决定。
试验可以将血液泵置于适当的生理学搏动负载中,来验证植入式左心室辅助系统(血泵、控制器)符合可靠性要求。运行相应的周期后,血液泵设备需要提供基本性能并保持安全,不允许出现影响设备基本性能的性能降低。
试验期间可以将故障分为以下几类,不能发生灾难性故障和致命性故障。
(1)灾难性故障。导致完全失去系统功能的故障定义为“灾难性故障”。如果此故障发生在临床上的话,有可能给患者造成严重的难以恢复的损伤,甚至造成死亡。
(2)致命性故障。导致系统无法安全稳定的实现其预期功能的故障定义为“致命性故障”。如果此故障发生在临床上且没有干预,有可能给患者造成损伤,甚至造成死亡。
(3)临界性故障。导致系统安全备份被破坏或导致系统进入非安全状态的故障定义为临界性故障。如果此故障发生在临床上,可能暂时不会造成患者的损伤,但如果不及时处理,也可能最终伤及患者。
(4)一般性故障。包括轻微性故障和可忽略故障。引发计划外维护,或造成系统表面损伤的故障定义为此类故障。此类故障在临床上不足以导致患者损伤。
测试系统还应模拟血泵转速、天然心脏搏动频率等参数按照每天三次调整来模拟人在一天中的各种活动状态。
(二)材料研究
应结合产品使用的环境要求以及材料本身特性进行材料选择,并提供相关研究资料。以下内容对材料选择和使用至关重要:抗挠性及硬度等弹性特性;屈服条件、应力-应变关系及滞后现象等塑性特性;弹性特性、蠕变、松驰、应变率效应等时变特性;裂纹扩展、疲劳、韧性—脆性转变等断裂特性;热膨胀、热导率及比热容等热特性;表面特性:为提高材料强度、硬度、疲劳寿命、润滑和/或散热性,应说明血液接触表面特性以及特殊器械表面处理;与环境产生的化学作用:由于水合作用、氧化作用、腐蚀、扩散作用、淋溶作用及与药物制剂接触的影响等。
(三)电气安全(含电磁兼容性)
应对含有电子元件的系统按照GB16174.1-2015、GB 9706.1-2007、GB9706.15-2008、YY 0505-2012进行电气安全(含电磁兼容性)测试。应将该产品作为生命支持设备进行测试,同时应考虑其预期使用环境的测试水平(如医院、家庭和救护车)。
(四)环境试验
按照GB 16174.1-2015和GB/T 14710-2009的相关要求进行环境试验,并提供试验报告。如采用其他的环境测试标准,则应说明其测试水平与预期的使用环境相适应(如医院、家庭、航空及救护车)。
(五)软件研究
1.软件资料要求
按照《医疗器械软件注册技术审查指导原则》提交软件资料。植入式左心室辅助系统属于高风险产品,参与对血泵驱动、控制等可能导致患者死亡或严重伤害的软件,安全性级别应定义为C。软件应包括血泵控制软件、监控器软件等。
2.信息安全要求
(1)根据《医疗器械网络安全注册技术审查指导原则》的要求提供网络安全注册申报资料。
(2)如果系统各组件间通讯使用了无线通讯技术: 应描述如何保证无线通讯的质量,以确保系统的安全性和有效性;应描述所采用的无线安全措施(比如WPA2无线加密等);描述存在的无线共存问题及风险降低措施。
(六)生物相容性评价
生物相容性评价应依照GB/T 16886系列标准进行,应当提供生物学评价方案和生物学评价报告。
应考虑生产加工工艺、灭菌工艺对于产品材料和潜在的可滤出物的影响,以及可能产生的毒性副产品。生物相容性试验应当使用经灭菌后的最终产品或代表性样品,并描述可能影响生物学评价的生产加工工艺、使用的生产助剂、清洗工艺等。
应提供生物学评价的路径,生物学实验选择的依据。对植入材料应考虑以下试验:细胞毒性试验;致敏试验;刺激试验;全身毒性(急性)试验;亚慢性毒性试验;遗传毒性试验;植入试验;血液相容性试验;血液学试验;凝血试验;补体激活试验;热原试验。
(七)体外溶血研究
应提供溶血指标的定义依据以及体外溶血的研究资料。推荐按照ASTM F1841中的方法进行体外溶血测试评估。
(八)灭菌工艺的研究
1.生产企业和终端用户灭菌:应明确产品灭菌的方法,灭菌方法选择的依据,提供微生物控制的方法及灭菌验证报告。
2.残留毒性:描述灭菌方法可能导致的残留物,对残留物控制的方法和限度,残留毒性不应对人体造成影响,并提供研究资料。
3.终端用户消毒(如适用):应当明确推荐的消毒工艺(方法和参数)以及所推荐消毒方法确定的依据。
(九)可用性
可用性评估应包含系统整体测试及其附属系统测试,软件及硬件的用户界面应是清晰易懂的且与目标使用人群相匹配(如物理、心理或感官上),这样才能减少错误和/或混淆的可能性。此外,设计适当的警报是非常必要的,警报用以提示使用者系统或子系统出现故障。评估中应考虑医院、运输、手术过程、家庭环境及紧急情况等条件,对象包括但不限于患者、看护人员、医护人员、手术外科医生、产品技术人员等。相关要求可参考标准YY/T 1474-2016(IEC62366-1:2015)及IEC60601-1-6:2013中内容。
(十)使用期限研究
参考《有源医疗器械使用期限注册技术审查指导原则》对有源医疗器械使用期限进行分析和研究,并提供相应的研究资料。应考虑产品使用前和使用后的期限,且应在正常和不利条件下对产品进行分析。
(十一)包装研究
无菌部件应考虑灭菌有效期。包装可分为运输包装和无菌包装,参考GB 16174.1-2015、ISO 14708-5:2010的内容。无菌包装应符合GB/T 19633《最终灭菌的医疗器械的包装》的要求,同时进行灭菌包装并对包装有效性进行确认。提供包装老化的测试报告。
在宣称的使用期限内以及运输储存条件下,保持包装完整性的依据。
四、生产制造信息
应当明确产品生产工艺过程,可采用流程图的形式,并说明系统过程控制点。且应注明关键工艺和特殊过程,并说明其过程控制点。明确生产过程中各种加工助剂的使用情况及对杂质(如残留单体、小分子残留物等)的控制情况。
五、动物实验评价资料
动物实验的目的是通过活体动物实验获得产品安全性和性能数据,对设计定型的产品进行临床前确认。
对于新研制的植入式心室辅助系统,在进入人体临床试验前,须进行动物实验。
对于已经上市应用于临床或已经完成动物实验确认的产品发生设计变更时,经过对变更部分与系统关系的评价后,可能会对系统重新进行动物实验;或者只针对更新部分进行动物实验;若有充分的证据证明可通过台架试验验证变更部分的安全性和有效性的,无需进行动物实验。
动物实验内容的要求参见附录1:植入式左心室辅助系统的动物实验研究。
六、产品风险分析资料
风险管理活动应贯穿于植入式左心室辅助系统的整个生命周期。申请人应参照YY/T 0316—2016建立植入式左心室辅助系统风险管理文档,风险管理文档应包括:风险管理计划(含风险管理可接受准则)、风险管理报告等。
在产品设计开发阶段,识别产品可能的危险(源)(Hazard),对产生的风险进行评估,针对性地实施降低风险的措施,并对所有剩余风险进行评价,达到可接受的水平。当剩余风险不符合风险管理计划设定的接受标准时,应收集并评审相关数据和文献,如果这些证据支持临床受益超过全部剩余风险的结论,则全部剩余风险可以判定为可接受,并在随附文件中包含相关的剩余风险的信息。
申请人应收集和评审产品在生产和生产后阶段的信息。申请人应建立程序文件来保证风险管理的持续性,包括但不限于不合格品控制程序、设计或者工程变更控制程序、市场监督和反馈处理程序、纠正和预防措施程序等。产品上市后对风险管理程序进行的更改需形成文件。
与植入式左心室辅助系统相关的具体风险管理内容见附录2:植入式左心室辅助系统的风险管理。
七、产品技术要求
(一)相关标准
我国目前还没有专门针对植入式左心室辅助系统的专标,与该产品相关的标准如下:
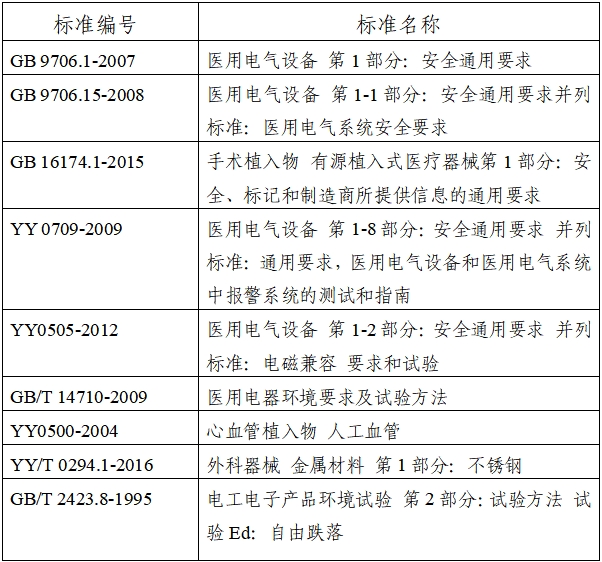
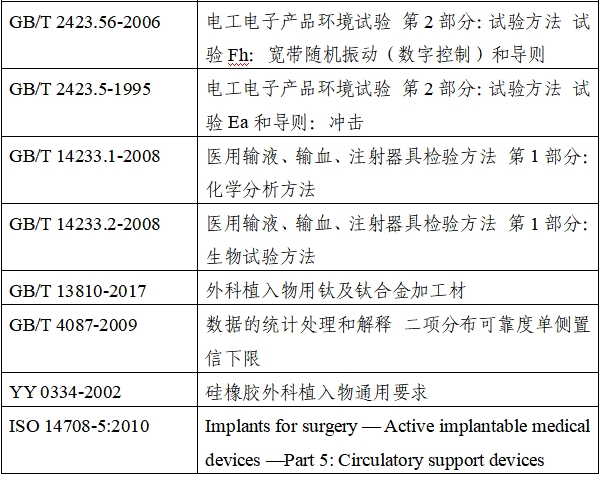
(二)相关内容
产品技术要求应当包括以下内容:植入式左心室辅助系统的型号及组成,其中应包含产品及关键部件的结构图(含剖视图、正视图、侧视图)及概述,植入部分以及与人体接触所使用的材料的名称、牌号以及符合的标准(如适用),软件名称、发布版本号和完整版本命名规则,产品的灭菌方法以及使用期限。植入式左心室辅助系统的性能指标,其中应包含产品的尺寸与重量,系统性能,血泵性能,体外控制器报警功能,监控器软件功能,手术工具,电缆性能,连接牢固度,物理特性,微生物要求(包含细菌内毒素),化学要求,材料要求,无菌及残留物要求,电气安全要求(含电磁兼容),报警系统要求,系统可靠性要求等。申请人应根据产品特点制定相应的性能指标和试验方法。
(三)性能指标和特性
1.尺寸与重量,主要产品与关键部件的尺寸及重量需标明。
2.系统性能,为了全面评价产品性能和产品与患者之间的相互作用,一般应包含如下测试:
(1)系统常规性能评价:由模拟试验台复现产品的预期适用人群的常规生理条件,将产品在该工作环境下以常规参数和条件运行,验证产品的设计性能指标。
(2)极端条件下的系统响应和效应:测试当患者或产品的工作状态、条件、参数偏离上述常规情形时,系统的响应和对患者可能产生的影响。
(3)显示范围以及显示精度:测试监控器或体外控制器的显示值的范围及精度。
3.血泵性能,例如:血泵的水力学性能评价,密封性评价,磁悬浮性能评价(如适用),血泵溶血性能评价等。
申请人应当对系统性能以及血泵性能进行测试并提交测试方法确定的依据。
4.体外控制器和备用控制器性能,包括血泵泵速调节功能和报警功能,并提供测试方法进行测试确认。
5.监控器软件功能,说明监控器的软件功能并提供测试方法进行测试确认。
6.电池充电器指示功能,说明不同状态下电池充电器的电源指示灯的指示状态,提供测试方法进行测试确认。
7.手术工具,包含手术工具的尺寸,重量,硬度,表面粗糙度,耐腐蚀性,锋利度(如适用),连接性能(如适用)等。
8.人造血管,应符合YY0500-2004的相关要求。(若有)
9.电缆性能,包含电缆的拉力、顺应性、抗扭性能,接头插拔性能等,申请人应当对上述电缆性能进行测试并提交测试方法及接受标准的确定依据。
10.连接线或连接器性能,主要包括血泵与控制器、控制器电源线与电池、人造血管与血泵、心室连接装置与血泵的连接强度、保持力、弯曲耐久性等。
11.缝合线和加强套管(在注册单元中)性能,主要包括缝合线外观、线径、抗张强度、褪色性能、长度以及加强套管支撑力等。
12.化学性能
(1)高分子材料的化学特性,含酸碱度、还原物质、重金属总含量、蒸发残渣、紫外吸光度等要求,检测方法参照GB14233.1-2008的要求。如果植入物包含硅橡胶,则需满足YY0334-2002的要求。
(2)金属材料,植入部分钛合金成分应符合GB/T 13810-2007中的要求,手术工具不锈钢(如适用),应符合YY/T0294.1-2016中的相关牌号的要求。
(3)无菌,标明无菌部件,按照中国药典2015版的检测方法检测。
(4)环氧乙烷残留量(如适用),包含各无菌部件环氧乙烷残留量的要求。
13.电气安全,系统应符合GB 9706.1-2007、GB 9706.15-2008的要求。
14.电磁兼容,系统应符合YY0505-2012的要求。
15.报警系统,系统应满足YY0709-2009的要求。
16.对环境影响的防护,应按照GB16174.1-2015中规定的方法对产品进行相关试验,同时结合GB/T14710-2009要求对产品进行温度存储试验,温度循环试验,振动试验,碰撞试验等。
17.网络安全(如适用),应符合《医疗器械网络安全注册技术审查指导原则》的相应要求。
18.可靠性测试,申请人应对整机进行可靠性测试,测试方法以及接受标准按照本指南上文条款,并参考ISO 14708-5:2010中6.112章节。
19.其他
避免对患者造成热伤害、外部物理特性造成对患者或使用者伤害的防护、对释放或发出的电离辐射的防护、对非预期作用的防护、由外部除颤器造成损坏的防护、对大功率电场直接作用于患者引起变化的防护、对混合医疗引起变化的防护、电流对患者造成伤害等应满足GB16174.1-2015的要求。
八、参考文献
1.ISO/DIS 14708-5 Implants for surgery — Active implantable medical devices —Part 5: Circulatory support devices,2019 DRAFT
2.ISO 14708-5 Implants for surgery — Active implantable medical devices —Part 5: Circulatory support devices, 2010版
3.《医疗器械动物实验研究技术审查指导原则 第一部分:决策原则》(国家药品监督管理局通告2019年第18号)
4.GB 31241-2014,《便携式电子产品锂离子电池盒电池组安全要求》
5.IEC 62133:2013,含碱性或其它非酸性电解液的蓄电池和蓄电池组—便携式密封蓄电池和蓄电池组的安全要求
6.UN38.3,联合国关于危险品运输的建议、手册及试验标准,第6次修订版
7.ASTM F1841,连续流动血泵溶血评定的标准操作规程
8.中国药典 2015版
九、起草单位
国家药品监督管理局医疗器械技术审评中心
附录:1.植入式左心室辅助系统的动物实验研究
2.植入式左心室辅助系统的风险管理
附录1
植入式左心室辅助系统的动物实验研究
1 .研究目的
1.1 概述
该部分内容中植入式左心室辅助系统动物实验的目的是通过活体动物实验获得产品安全性和性能数据,对设计定型的产品进行临床前确认。
1.2 安全性
安全性能应通过合适的动物模型来评价,研究指标包括但不限于:出血、血栓形成、溶血、栓塞、神经系统事件、钙化、血管翳形成、末端器官功能障碍、梗死、感染、装置有无功能失效、装置腐蚀、密封完整性、磨损、局部组织反应、临床病理学、血流动力学稳定性等。这些研究指标来自动物实验过程中的临床观察和解剖发现。产品植入部分经过的体表及体内路径、预期植入体内位置周围的组织和器官也要进行安全性评价。
1.3 性能评价
性能是指植入式左心室辅助系统是否可在规定的时间内提供可接受的血液循环系统支持的能力。
2 .实验产品
动物实验产品应为设计定型的产品。如果动物实验所用产品非设计定型产品,需要分析两者之间的差异,并给出合理的理由说明这些差异不会影响动物实验研究结果,且不会对临床使用引入新的风险。
3 .动物选择及实验过程
3.1 动物选择
需记录动物种类(如牛、羊)、数量、品系、性别、重量、动物供应者名称和地址。动物标识、个体耳标、笼贴或对应物均应记录,以保证每个个体动物的历史记录是精确的。动物模型的选择应考虑以下情况并给出合理解释:
①植入式左心室辅助系统不适合选用非哺乳类动物进行动物实验研究;
②所选动物的心脏大小、主要血管尺寸应与人类相似;
③应评价所选动物模型的凝血反应的合理性,排除有出血倾向和凝血机制过度活跃的动物;
④应对比所选动物与预期患者人群的红细胞机械应力的敏感度,以评估实验装置的溶血性能。
3.2 实验基本条件
具备外科无菌手术室基本条件,配备麻醉机、呼吸机、心脏超声等基本手术设备。
3.3 样本量及植入周期
应当根据产品预期用途采用合适的样本量及植入周期,以确认装置在动物体内的安全性和性能,并为临床适应症的确定提供依据。
3.4 对照组
植入式左心室辅助系统的动物实验可不设定对照组,但实验动物术后的生命体征和血液化验结果需与术前基准值进行对比,用于评价动物生理状况的改变。
3.5 术前动物护理
需记录所用动物的来源、种类、年龄、性别、体重、编号等。
动物实验机构应制订标准操作程序,按照标准操作程序对动物进行术前护理。
3.6 植入过程
为保证动物实验的研究质量,应制定植入方案,以避免不同术者手术操作差异、动物麻醉死亡、手术死亡、术后感染及其它意外情况对产品评价产生影响,并对术者和参与研究人员进行培训。植入方案包括但不限于以下内容:
①麻醉;
②左心室辅助系统植入步骤;
③术中及术后用药;
④监护和动物管理
3.7 术后护理
术后护理由动物实验机构按照标准操作程序进行,并制订与装置相关的动物护理和健康管理方案。
3.8 术后抗凝
考虑到植入式左心室辅助系统的适应症以及药理学和抗血栓药物对动物的凝血系统的影响,抗血栓(抗凝和抗血小板)药物的使用需要给出合理解释。如果需要使用抗凝和抗血小板药物,必须提供抗血栓药物的使用方案。给药时间、剂量及凝血指标测量结果需要进行完整记录。
3.9 提前终止说明
如果植入手术被判定为失败,或者出于人道主义考虑动物达到了安乐死的条件,对动物处以安乐死后,应补充新的动物加入实验。人道主义安乐死指标应在实验开始之前定义。动物因与实验产品功能无关的原因,或不可抗环境因素而导致不能正常存活的情况,可不纳入研究范围内。
提前终止实验的动物或意外死亡的动物需要做全面的系统性大体观查,包括植入部件的原位检查,主要器官、损伤组织及植入部件周围的局部组织样本的病理评估。植入部件移除后应进行总体评估、组织学检查,并对移除产品或部件进行工程分析。所有发现都应做记录,包括观察项、根本原因分析和动物提前终止实验的结论。
应记录所有与产品研发和实验相关的动物,包括早期被人道主义安乐死和意外死亡的动物。
4 .实验内容
4.1 实验成功定义
动物实验方案应对实验成功进行定义。
比如:动物存活且:
①器械的植入部件无失效。失效定义为在没有外科手术干预的情况下无法修复的故障。但不产生严重的手术并发症的修复或组件替换不包括在内。
②在整个研究期间内,能够持续提供预设的流量,在关键时间节点采用流量计与血泵显示数据进行对比评价,该流量的设定要符合产品适应症。
③无临床不可接受的主要器官功能障碍或溶血,例如:
a)肾功能障碍:肌酸酐超过正常动物术前基准值上限3倍;
b)肝功能障碍:术后14天之后,肝功指标AST、ALT、总胆红素任意2个指标超过正常动物术前基准值3倍;
c)溶血:血浆游离血红蛋白>40mg/dL,且在连续2天内血浆游离血红蛋白测定结果未下降至40mg/dL及以下。与装置关联性的判断标准:因输血、药物等与装置不相关因素造成的溶血,属与装置无关的不良事件;术后72小时后,不是因输血、药物等与装置不相关因素而造成的严重溶血,属于与装置相关的不良事件。
④未发生由装置引起的具有临床表现的血栓栓塞。若根据临床症状和尸检表明,血栓栓塞是与器械无关的病原学导致的,则不视为失败。例如,血管意外创伤,或血泵血栓的产生是由不可控因素导致血泵停止(例如地震、失火、经皮电缆被动物咀嚼等)。为避免重新启动血泵产生血栓,建议方案中定义重新启动血泵前的最大停泵时长。
⑤未发生与器械相关的严重感染。全身感染和局部感染需满足以下条件才定义为“严重”:对全身感染,在抗菌治疗下(不包含日常预防性治疗),血培养成阳性且无法改善的定义为严重。经皮电缆处的局部感染不视为“严重”,除非其导致全身感染。根据临床症状和尸检确定的、与器械无关的(例如水污染导致的环境问题,静脉注射意外导致的微生物污染等)病原性感染不应视为器械失败。无论任何感染都应记录。
⑥与血泵功能无关,或实验室不可控的原因而导致动物无法成功存活,不应视为失败。
4.2 不良事件定义
植入式心室辅助装置可能出现的不良事件包括死亡、器械/系统故障、出血、感染、溶血、神经系统功能障碍、血栓栓塞、心血管功能障碍或器官衰竭等。动物实验方案应给出不良事件的定义,在动物实验期间出现的所有不良事件都需记录并判定其与器械的关联性。
不良事件的定义可以参考INTERMACS Adverse Event Definitions: Adult and Pediatric patients。
4.3 装置相关参数记录
动物实验期间要根据装置的性能指标记录相关参数,保证参数真实、准确。
4.4 生理参数记录
动物实验期间要记录动物相关的生理参数。
包括但不限于:呼吸频率、心率、体温、每日动物的整体状况、液体出入量。
4.5 血液化验
应在整个动物实验术前、术中和术后规定的时间点进行血液采集化验,包括但不限于血常规、血生化、血浆游离血红蛋白、凝血。
5 .实验结束后取材
5.1 尸体解剖及器械取出
需要提供尸体解剖及器械取出的方案,包括但不限于:安乐死的方式、原位拍摄、主要器官的固定方式、取出器械的冲洗及固定方法。
5.2 大体观察
对试验动物进行完整、详细的大体观察,并记录所有观察结果。
详细检查器械是否有明显的机械性能变化、腐蚀、磨损、密封完整性破坏、感染性赘生物、血栓钙化、组织反应及其他可见异常情况,所有观察结果需进行记录。
5.3 病理检查
需要对主要器官(包括脑、肝、肾、心、肺、脾、主动脉吻合口和插管上下游血管等)及所有肉眼可见的病灶进行显微镜检查,并记录结果。
5.4 对移除器械进行分析
器械分析应当考虑但不限于以下方面:
a) 制订完整的器械拆卸要求,以便对移除器械进行电气分析、血液相容性分析(如对血液接触表面进行肉眼/显微镜检查、拍照及扫描电镜评价),同时对部件的机械性能进行评价。
b) 在拆卸过程中,应对密封及连接情况进行评价。应检查密封性是否完整,血液通道的连接处是否存在血栓,同时还应检查电气连接、腐蚀及电缆线屏蔽层(如适用)的完整性。
c) 应检查导线、电气连接及机械连接、器械组件及系统的其他部件,是否有损坏、磨损、衰退、腐蚀或其他异常现象。
6 .动物实验数据分析
应对方案里所有采集的数据进行数据分析,以证明器械在活体中的安全性和器械性能,基于分析结果以及研究方案中定义的成功标准,对器械的临床应用可行性进行评估。
附录2
植入式左心室辅助系统的风险管理
风险管理活动应贯穿于植入式左心室辅助系统的整个生命周期。应对由单个故障条件引起的、与设备功能和安全相关的危险(源)(Hazard)加以识别,对其产生伤害(Harm)的可能性
进行评估和控制,且不会引起不能接受的风险(Risk)。
需对整个系统及各系统组件进行综合风险分析,包括人为因素。风险分析包括自上而下分析(如危险性分析、故障树分析法)、自下而上分析(如故障模式、影响及危害性分析)、潜在使用或使用者错误分析(人为因素分析)。进行风险分析时应对故障模式的严重性及发生概率进行分类。所有故障应分为以下五类:致灾难性故障、致命性故障、临界性故障、轻微性故障、可忽略故障。还需详细描述缓解故障模式危险程度的方法。
一、植入式左心室辅助系统在设计开发中的风险管理
在植入式左心室辅助系统的产品可行性评审阶段,应对产品可能的风险进行识别,并初步拟定风险控制措施。该阶段的风险分析结果需作为产品设计输入的一部分。
该阶段风险识别的方法是:根据产品的预期用途和安全性特征,识别出可能的风险,如:
分析在正常和单一故障条件下,与产品有关的已知或可预见的危险(源)(Hazard),评估每个危害情况(Hazard Situation)的风险;分析产品的可能生物学危险(源)(Hazard),评估每个危险情况(Hazard Situation)的风险。
在植入式左心室辅助系统的产品设计开发评审阶段,应进行风险管理活动。该阶段风险管理的方法可以采用FMEA (包括Design FMEA、Software FMEA及Human Factor FMEA)、PHA、FTA、HAZOP或者HACCP等方法,针对设计组件或系统模块可能产生的风险进行分析。
二、植入式左心室辅助系统在生产中的风险管理
在植入式左心室辅助系统的生产工艺确认(Process Validation)阶段,应进行风险管理活动。该阶段风险管理的方法可以采用Process FMEA等方法,根据产品的生产工艺流程,对每一生产工序或步骤,列出可能的失效模式,分析其对用户的伤害(Harm),并拟定降低风险的控制方法。
三、与植入式左心室辅助系统特性相关的危险(源)(Hazard)
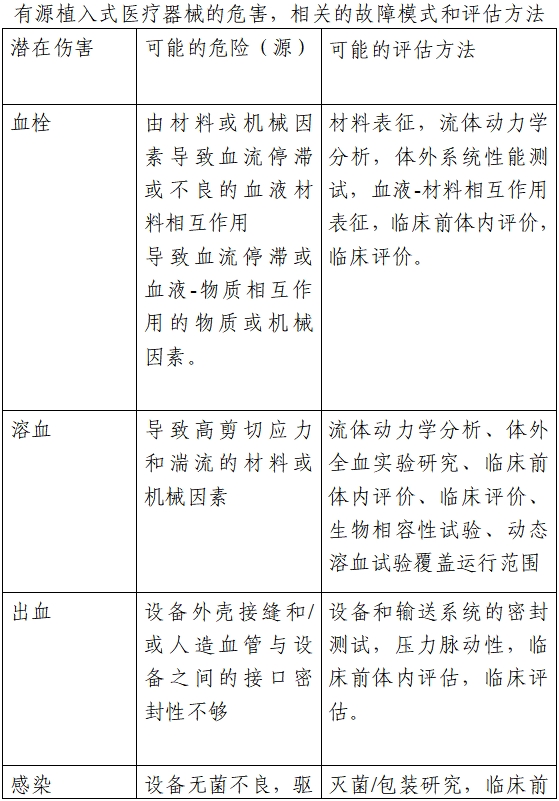
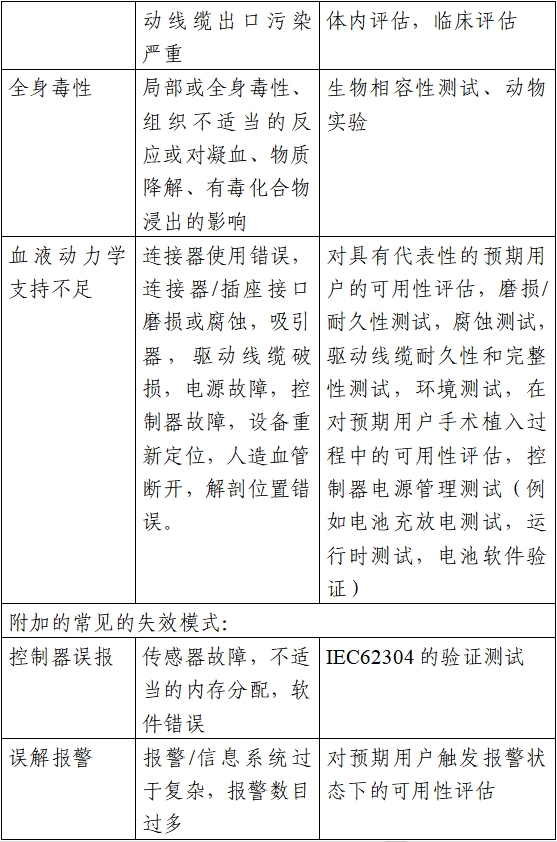
与植入式左心室辅助系统特性相关的危害,包括但不限于:系统流量过高;系统流量过低;系统泄漏(如血泵密封泄漏、出口管/人造血管泄漏);气蚀;血液通道内空气栓塞;血泵高剪切应力;流道内流体滞留;显示错误或不准确的信息;经皮电缆皮肤出口处的微生物侵入;错误的报警信息;报警功能失效;入口管插入心室的角度不合理;移除的心肌组织进入血液循环系统等。下表举例给出了典型的危害、相关的故障模式和可能的评估方法。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
行业资讯
知识分享









 豫公网安备 41010202003160号
豫公网安备 41010202003160号