浅谈医疗器械风险管理的定义和流程
发布日期:2023-10-10 阅读量:次
医疗器械风险管理是一个不断发展不断迭代的过程,随着监管机构对风险管理的认识不断加深,对风险管理的要求也越来越严格。我们企业内更要增强对风险管理的重视,充分认识到风险管理在产品全生命周期中所起的重要作用,真正做到风险管理为保障产品安全起到应有的作用。
本篇文章小编就带大家深入浅出的了解一下医疗器械风险管理相关内容。

一、什么是医疗器械风险管理?
风险管理是贯穿于医疗器械全生命周期的活动,对保证医疗器械的安全具有非常重要的作用。我国《医疗器械监督管理条例》(国务院令 第739号)明确规定,国家对医疗器械按照风险程度实行分类管理,并将产品风险分析资料作为第一类医疗器械备案和二、三类医疗器械注册应当提交的技术文件之一。
二、医疗器械风险管理的相关法规及标准
目前我国现行有效的医疗器械风险管理标准为YY/T 0316-2016《医疗器械 风险管理对医疗器械的应用》,等同采用ISO 14971:2007更正版。欧盟MDR附录Ⅰ第一章给出了风险管理的详细要求。
2019年,国际标准化组织(ISO)发布了第三版风险管理标准ISO 14971:2019,同年,欧盟不做任何修订的采用该标准为协调标准EN ISO 14971:2019。
三、医疗器械风险管理流程
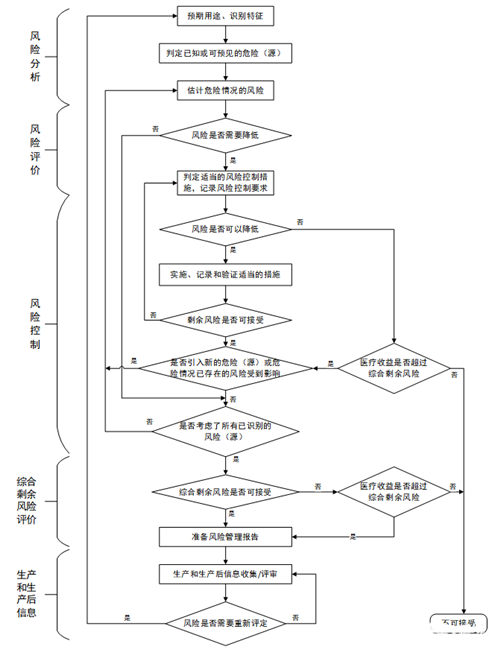
3.1风险分析
风险分析是风险管理中最重要的环节,是风险管理的第一步。只有准确、全面的分析产品的风险才可能制定出有效的风险管理控制措施,降低产品的风险。风险的识别可参照YY/T 0316-2016附录C。
除了判定已知和可预见的风险,怎样识别更多的风险?简单说就八个字:事无巨细,抓大放小。
事无巨细就是不放过任何一个有潜在风险的可能,不管它藏在什么犄角旮旯,拿着放大镜甚至显微镜都得把它搜罗出来。
在搜罗风险的时候,有一个很好用的原则叫:假设我们什么也不做原则。
举个例子,比如说你的产品是一个穿刺针。
如果我们什么也不做,那么使用穿刺针会给患者带来侵入性细菌感染的风险。
为了消除这个风险,我们设定了灭菌控制程序,并严格监控了微生物残余量,以确保穿刺过程带给患者的外来病菌数量达到最小化和安全化。
要做到事无巨细地揪风险,除了需要对自家产品了如指掌的认知外,还需要一颗追求完美的心。不擅长此道的亲们,需要多跟身边处女座的朋友们取取经哦。
3.2风险评价
风险评价就是根据我们风险管理计划中规定的准则对分析出的风险源进行判定,判定准则一般是由损害的发生概率与损害严重程度相结合。
下面这张表比较直观地表现出了这两个条件组合的多样性。左边一列是危害发生几率,上边一行是危害程度。
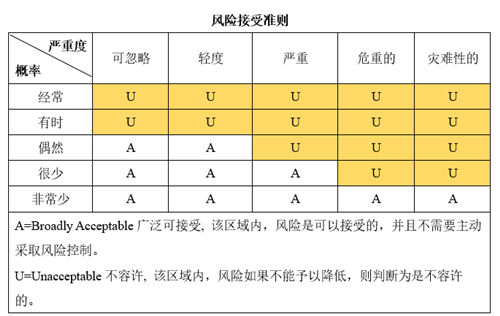
简单剖析一下:
如果有源器械客户摸电门触电,好奇害死猫那种。这种风险其实真的挺让人一言难尽的。但天要下雨,客户要摸电门,这都是我们改变不了的,只能警告, 警告 再警告 。当然这种风险属于损害严重程度极高,发生概率极低的啦~
但还有一个潜在群体,就是那些存在感中等,杀伤力也中等的,因为两个技能出现了叠加效应,已经算狠角色了,但却混迹于一堆中等风险中,更容易被忽略掉。
——比如医生给患者打针,打到一半针头脱了,然后就看血从针孔头中喷涌而出,再换一个还不密封,最后发现换了一批都不密封。想想那画面,多惊悚,病人很难分清自己是被吓晕的,还是失血过多晕的。。。。。
3.3风险控制
风险控制就是将经风险分析后,那些不能接受的风险源,或可以降低风险等级的风险源,通过某些措施将风险控制在可接受范围内。
ISO 14971标准按照优先级的不同,从高到低给出三种风险控制方式:
1、使用设计方法取得固有安全性;
2、在医疗器械本身或在制造过程中的防护措施;
3、安全性信息和适当时的用户培训。
“使用设计方法取得固有安全性”是优先级最高的选项,因为再好的保护措施也有可能失效,或者再好的“安全信息”(说明书、警示标语等)也可能被忽略。
3.4综合剩余风险评价
当所有的风险控制措施都已经实施并验证后,企业应再次利用风险接收准则,决定是否由医疗器械造成的综合剩余风险都是可以接受的。
综合剩余风险简单讲就是把经风险控制后的所有危险(源)放在一起看一看会不会有异常情况发生。
举个例子:有源医疗器械高温的危险(源)可能会对漏电流的危险(源)产生影响,原因是高温会导致绝缘体的绝缘特性降低。那么如果在经过风险控制措施之后,如果这两个危险(源)都落在最低合理可行区,假设高温的危险(源)发生了对病患造成了伤害,就有可能会导致漏电流的危险(源)对病患产生伤害的概率变高,就会落在不可接受区。因此要做整体的剩余风险分析。
在设计开发结束前,需对风险管理过程进行评审,并输出风险管理报告。评审主要目的是确保:
1、风险管理计划已经被适当的实施;
2、综合剩余风险可接受;
3、已有适当方法获得相关生产和生产后信息。
3.5生产和生产后信息
风险管理是一个迭代的工作,会涉及到生产和生产后信息的收集。原因非常简单,你今天做的风险管理工作是基于你现在知道的信息,产品上市之后你会了解到更多的信息,这些信息可能会和你之前在做风险管理工作时用到的信息有出入。
生产及生产后信息主要来源于用户,需要针对不同的产品建立生产和生产后信息收集的具体方法,比如按《顾客反馈控制程序》收集产品相关信息,进行风险管理。
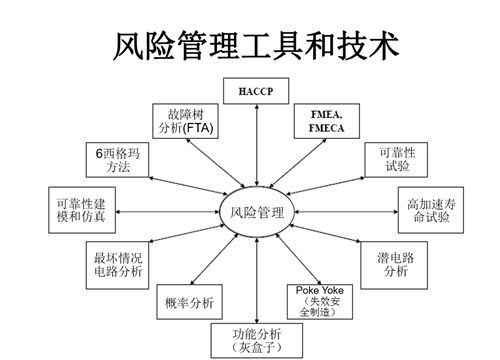
四、风险管理工具和技术
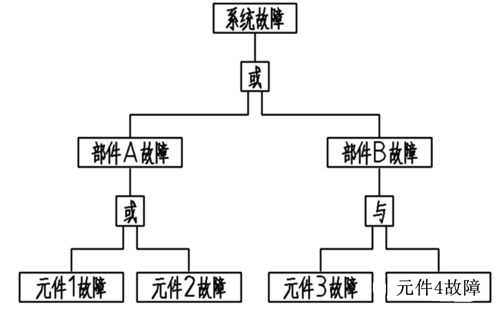
简单的故障树
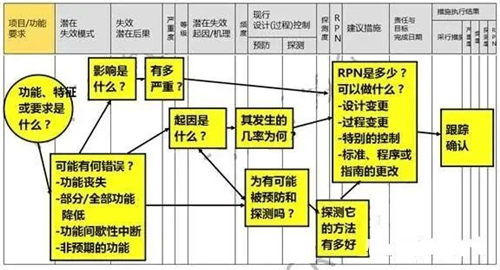
FMEA
风险管理在各行业存在着不同的技术工具,也有一定的共通性,上图列举了一些医疗器械风险管理的常用工具及技术,大家如果兴趣可以自行查阅学习。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
行业资讯
知识分享








 豫公网安备 41010202003160号
豫公网安备 41010202003160号